题目内容
下列叙述正确的是( )
| A、无论是纯水,还是酸性、碱性或中性稀溶液,在常温下,其c(H+)?c(OH-)=1×10-14 |
| B、c(H+)等于1×10-7mol?L-1的溶液一定是中性溶液 |
| C、0.2 mol?L-1CH3COOH溶液中的c(H+)是0.1 mol?L-1CH3COOH溶液中的c(H+)的2倍 |
| D、任何浓度的溶液都可以用pH来表示其酸性的强弱 |
考点:水的电离,弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、根据常温下温度离子积进行判断;
B、根据中性溶液中氢离子浓度等于氢氧根离子浓度进行判断;
C、根据醋酸浓度增大,电离程度减小进行分析;
D、根据溶液的酸碱度用PH来表示,其范围一般在 0~14之间进行判断.
B、根据中性溶液中氢离子浓度等于氢氧根离子浓度进行判断;
C、根据醋酸浓度增大,电离程度减小进行分析;
D、根据溶液的酸碱度用PH来表示,其范围一般在 0~14之间进行判断.
解答:
解:A、常温下[H+]=[OH-]=1×10-7mol?L-1,[H+]?[OH-]=1×10-14mol2?L-2,故A正确;
B、由于水的离子积受温度影响,中性溶液中[H+]=[OH-],不知道溶液中氢氧根离子浓度,无法判断溶液是否显示中性,故B错误;
C、醋酸是弱电解质,浓度增大,醋酸的电离程度减小,所以0.2 mol/L CH3COOH溶液中的[H+]小于0.1 mol/L CH3COOH溶液中的[H+]的2倍,故C错误;
D、pH范围一般在 0~14之间,溶液中的氢离子在1~10-14mol/L,故D错误;
故选A.
B、由于水的离子积受温度影响,中性溶液中[H+]=[OH-],不知道溶液中氢氧根离子浓度,无法判断溶液是否显示中性,故B错误;
C、醋酸是弱电解质,浓度增大,醋酸的电离程度减小,所以0.2 mol/L CH3COOH溶液中的[H+]小于0.1 mol/L CH3COOH溶液中的[H+]的2倍,故C错误;
D、pH范围一般在 0~14之间,溶液中的氢离子在1~10-14mol/L,故D错误;
故选A.
点评:本题考查了水的电离平衡及pH的使用范围,注重了基础知识的考查,可以根据所学知识完成,本题难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
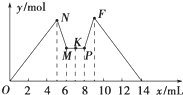 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
从利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序主要跟下列有关的是( )
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
| A、①③ | B、②④ | C、③⑤ | D、②⑤ |
下列说法或表示法正确的是( )
| A、1mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| D、在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧产生的热量不相等 |
下列沸点最高的是( )
| A、正戊烷 | B、异戊烷 |
| C、丁烷 | D、丙烷 |
下列过程属于熵增加的是( )
| A、一定条件下,水由气态变为液态 |
| B、2H2(g)+O2(g)═2H2O(g) |
| C、HCl(g)+NH3(g)═NH4Cl(s) |
| D、NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g) |
下列关于胶体与溶液的说法正确的是( )
| A、向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体 |
| B、利用滤纸可以分离胶体与溶液 |
| C、胶体与溶液的本质区别在于能否发生丁达尔效应 |
| D、蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 |
将CH4和C2H4的混合气体15g通入盛有足量溴水的容器中,溴水的质量增加了7g,则混合气体中CH4和C2H4的体积比为( )
| A、1:2 | B、2:1 |
| C、3:2 | D、2:3 |