题目内容
 如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度
如图表示反应X(g)═4Y(g)+Z(g)△H<0,在某温度时X的浓度随时间变化的曲线.下列有关该反应的描述正确的是( )
| A、该反应的过程是熵减小的过程 |
| B、若降低温度,v正减小,v逆增大 |
| C、第6min后,反应就停止了 |
| D、X在第一分钟和第二分钟内的平均反应速率之比是3:2 |
考点:物质的量或浓度随时间的变化曲线
专题:
分析:A.根据该反应前后的气体物质的量判断;
B.降温使正逆反应速率减小.
C.反应达到平衡是动态平衡,反应没有停止;
D.计算X在第一分钟和第二分钟内的平均反应速率,判断速率之比.
B.降温使正逆反应速率减小.
C.反应达到平衡是动态平衡,反应没有停止;
D.计算X在第一分钟和第二分钟内的平均反应速率,判断速率之比.
解答:
解:A.该反应为气体物质的量增大的反应,即混乱度增大,为熵增大的反应,故A错误;
B.若降低温度,v正和v逆均减小,故B错误;
C.反应达到平衡是动态平衡,正逆反应速率相同,反应仍然进行,故C错误;
D.X在第一分钟内,浓度变化为(1.0-0.7)mol/L=0.3mol/L,反应速率为0.3mol/(min?L),X在第二分钟内,浓度变化为(0.7-0.5)mol/L=0.2mol/L,反应速率为0.2mol/(min?L),则X在第一分钟和第二分钟内的平均反应速率之比是3:2,故D正确.
故选:D.
B.若降低温度,v正和v逆均减小,故B错误;
C.反应达到平衡是动态平衡,正逆反应速率相同,反应仍然进行,故C错误;
D.X在第一分钟内,浓度变化为(1.0-0.7)mol/L=0.3mol/L,反应速率为0.3mol/(min?L),X在第二分钟内,浓度变化为(0.7-0.5)mol/L=0.2mol/L,反应速率为0.2mol/(min?L),则X在第一分钟和第二分钟内的平均反应速率之比是3:2,故D正确.
故选:D.
点评:本题考查化学平衡影响因素方向判断,掌握化学平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
实验室里取用金属钠时,用到的仪器用品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片或培养皿.
| A、①③⑤⑦ | B、②④⑦⑧ |
| C、③④⑤⑧ | D、②③④⑧ |
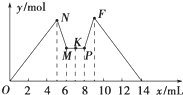 如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )
如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图.根据图示判断,下列结论中不正确的是( )| A、N点时溶液中的溶质只有NaCl |
| B、M点之前加入的是NaOH溶液,M点之后加入的是盐酸 |
| C、c(NaOH)=c(HCl) |
| D、原混合溶液中c(MgCl2):c(AlCl3)=1:1 |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | Ki=3×10-8 |
| H2CO3 | Ki1=4.3×10-7 |
| Ki2=5.6×10-11 |
| A、c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) |
| B、c(ClO-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(HCO3-)>c(ClO-)>c(OH-)>c(H+) |
| D、c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
同物质的量浓度、同体积的HCl和醋酸溶液,分别与过量相同情况的Na2CO3固体反应时,下列叙述正确的是( )
| A、反应速率HCl>CH3COOH |
| B、气泡逸出速率CH3COOH>HCl |
| C、在相同条件下两酸产生的CO2的体积不相同 |
| D、如果两酸的c(H+)相同时,两酸的物质的量浓度HCl>CH3COOH |
反应C(s)+H2O(g)?CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎没影响的是( )
| A、增加C的量 |
| B、将容器的体积缩小一半 |
| C、投入一块钠 |
| D、保持压强不变,充入Ar使容器容积变大 |
从利用金属的历史来看,先是青铜器时代,而后是铁器时代,铝的利用是近百年的事.这个先后顺序主要跟下列有关的是( )
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
①地壳中金属元素的含量;
②金属活动性顺序;
③金属的导电性;
④金属冶炼的难易程度.
| A、①③ | B、②④ | C、③⑤ | D、②⑤ |
下列说法或表示法正确的是( )
| A、1mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 |
| B、由C(石墨)→C(金刚石)△H=+119 kJ?mol-1可知,石墨比金刚石稳定 |
| C、在101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ?mol-1 |
| D、在101 kPa,298 K条件下,1 mol S和2 mol S的燃烧产生的热量不相等 |
下列关于胶体与溶液的说法正确的是( )
| A、向沸水中滴加饱和氯化铁溶液可制得氢氧化铁胶体 |
| B、利用滤纸可以分离胶体与溶液 |
| C、胶体与溶液的本质区别在于能否发生丁达尔效应 |
| D、蔗糖、淀粉、蛋白质的水溶液均能产生丁达尔现象 |