题目内容
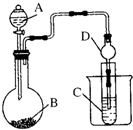
8.下列实验装置能达到实验目的是(夹持仪器未画出)( )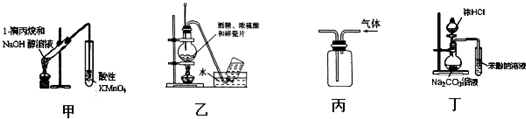
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
分析 A.醇易挥发,且醇能被高锰酸钾氧化;
B.需要测定反应液的温度为170℃;
C.甲烷的密度比空气密度小;
D.盐酸易挥发,盐酸与苯酚钠反应.
解答 解:A.醇易挥发,且醇能被高锰酸钾氧化,则高锰酸钾褪色,不能说明烯烃的生成,故A错误;
B.需要测定反应液的温度为170℃,温度计的水银球应在液面下,故B错误;
C.甲烷的密度比空气密度小,则图中短导管进气为向下排空气法,故C正确;
D.盐酸易挥发,盐酸与苯酚钠反应,则图中装置不能比较碳酸、苯酚的酸性,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,把握物质的性质、制备实验、性质实验及气体的收集为解答的关键,注意实验的严密性和合理性及实验技能,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.
(1)化学性质最不活泼的元素的原子结构示意图为 .
.
(2)元素⑧的名称为氯,其最高价氧化物的水化物的化学式为HClO4.
(3)元素③与元素⑧形成的化合物的电子式为 .
.
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K(填元素符号);元素①单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是NaOH.
(6)能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ④ |
 .
.(2)元素⑧的名称为氯,其最高价氧化物的水化物的化学式为HClO4.
(3)元素③与元素⑧形成的化合物的电子式为
 .
.(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K(填元素符号);元素①单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是NaOH.
(6)能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
16.某化学兴趣小组利用如图装置验证元素非金属性的变化规律.下列说法正确的是( )

| A. | 仪器A的名称长颈漏斗,仪器 D的名称为球形干燥管 | |
| B. | 若利用上装置验证非金属性:Cl>S,装置A、B、C中所装药品应分别为稀盐酸、MnO2、Na2S溶液 | |
| C. | 若利用上装置证明非金属性:S>C>Si,装置A、B、C中所装药品应分别为稀硫酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:S>C>Si | |
| D. | 装置A、B、C中所装药品应分别为稀盐酸、Na2CO3溶液、Na2SiO3溶液,观察到B中产生气泡,试管C中出现白色沉淀现象,则可以证明非金属性:Cl>C>Si |
3.下列有机物的结构表示不正确的是( )
| A. | CH4的球棍模型示意图为: | B. | 乙烯的实验式为:CH2 | ||
| C. | 乙醇的结构简式:C2H5OH | D. | 2-乙基-1,3-丁二烯分子的键线式: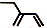 |
13.将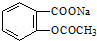 转变为
转变为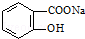 的方法为( )
的方法为( )
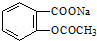 转变为
转变为 的方法为( )
的方法为( )| A. | 溶液加热,通入足量的HCl | |
| B. | 与足量的NaOH溶液共热后,再通入CO2 | |
| C. | 与稀H2SO4共热后,加入足量的Na2CO3 | |
| D. | 与稀H2SO4共热后,加入足量的NaOH |
20.下列说法正确的是( )
| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 物质发生化学变化一定伴随着能量变化,且能量形式只表现为热量变化 | |
| C. | 把石墨完全转化为金刚石时,要吸收能量,所以石墨不如金刚石稳定 | |
| D. | 原子结合成分子的过程一定释放出能量 |
18.下列有关说法正确的是( )
| A. | 氨水稀释后,溶液中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$的值减小 | |
| B. | 0.1 mol•L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 | |
| C. | 298 K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其△H<0 | |
| D. | 对N2(g)+3H2(g)═2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |