题目内容
18.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ⑥ | ⑦ | ⑨ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | ||||
| 4 | ② | ④ |
 .
.(2)元素⑧的名称为氯,其最高价氧化物的水化物的化学式为HClO4.
(3)元素③与元素⑧形成的化合物的电子式为
 .
.(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K(填元素符号);元素①单质与水反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑.
(5)①、③、⑤三种元素的最高价氧化物为水化物中,碱性最强的化合物的化学式是NaOH.
(6)能形成两性氢氧化物的元素是Al(用元素符号表示),写出该元素的单质与①的最高价氧化物的水化物反应的化学方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为F、⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,根据核外电子排布画出原子结构示意图;
(2)元素⑧是氯元素,最高价氧化物的水化物为高氯酸;
(3)元素③与元素⑧形成的化合物为MgCl2,由镁离子与氯离子构成;
(4)同周期自左而右非金属性增强、原子半径减小,同主族自上而下非金属性减弱、原子半径增大;钠与水反应生成氢氧化钠与氢气;
(5)金属性越强,最高价氧化物的水化物碱性越强;
(6)氢氧化铝是两性氢氧化物,Al与氢氧化钠反应生成偏铝酸钠氢气.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为F、⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素⑧是氯元素,最高价氧化物的水化物为高氯酸,化学式为HClO4,故答案为:氯;HClO4;
(3)元素③与元素⑧形成的化合物为MgCl2,由镁离子与氯离子构成,电子式为: ,
,
故答案为: ;
;
(4)同周期自左而右非金属性增强、原子半径减小,同主族自上而下非金属性减弱、原子半径增大,故上述元素中非金属性最强的为F,原子半径最大为K;钠与水反应生成氢氧化钠与氢气,反应离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
故答案为:F;K;2Na+2H2O=2Na++2OH-+H2↑;
(5)金属性Na>Mg>Al,金属性越强,最高价氧化物的水化物碱性越强,故碱性NaOH>Mg(OH)2>Al(OH)3,
故答案为:NaOH;
(6)Al元素的氢氧化物--氢氧化铝是两性氢氧化物,Al与氢氧化钠反应生成偏铝酸钠与氢气,反应方程为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:Al;2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
点评 本题考查元素周期表与元素周期律的综合应用,侧重对元素周期律的考查,熟练掌握周期表的结构,注意对基础知识的巩固.

| A. | 乙烯和苯使溴水褪色的原理不同 | |
| B. | 乙烯和聚乙烯中都有碳碳双键 | |
| C. | 煤的气化和液化都是化学变化 | |
| D. | 甲烷中混有乙烯时,仅用酸性KMnO4溶液不能提纯 |
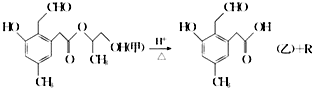
| A. | R为二元醇,不能发生银镜反应 | |
| B. | 1 mol甲在一定条件下与氢气反应,最多可消耗 5mol H2 | |
| C. | 甲在碱性条件下也可发生水解反应 | |
| D. | 甲和乙均能发生银镜反应 |
| A. | 它的最外层电子数为4 | B. | 它的金属性比铅强 | ||
| C. | 它的最高价氧化物的水化物是强酸 | D. | 它的位置在第7周期IVA族 |
 “即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )
“即食即热型快餐”适合外出旅行时使用.其内层是用铝箔包裹的并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是( )| A. | 氢氧化钡晶体和氯化铵晶体 | B. | 生石灰与水 | ||
| C. | 金属钠与水 | D. | 氯化钠与水 |
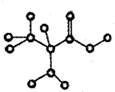 如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )
如图是某有机物简易球棍模型,已知它只含有C、H、O、N四种元素,下列关于该有机物的说法正确的是( )| A. | 分子式为C3H7NO | |
| B. | 不能和NaHCO3溶液反应生成CO2 | |
| C. | 该分子中至少存在5个原子一定共面 | |
| D. | 可以与醇发生酯化反应 |
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应.
乙:向反应混合液中滴入硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应.
则有关上述实验方案的叙述正确的是( )
| A. | 甲正确 | B. | 乙正确 | C. | 甲、乙均正确 | D. | 甲、乙均不正确 |
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
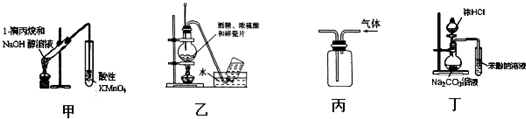
| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |