题目内容
17.有下列几种物质:①氯化铵 ②氦气 ③氯化镁 ④二氧化碳⑤过氧化氢 ⑥氯化钠 ⑦过氧化钠
其中:a.只含离子键的物质是③⑥(填编号,下同)
b.只含共价键的物质是④⑤
c.既有离子键又共价键的是①⑦.
分析 一般来说,活泼金属元素与非金属元素形成离子键,非金属元素之间形成共价键,以此来解答.
解答 解:①氯化铵中含离子键和N-H共价键;②氦气中不含化学键;③氯化镁中只含离子键;④二氧化碳中只含共价键;⑤过氧化氢只含共价键;⑥氯化钠只含离子键;⑦过氧化钠中含离子键和O-O共价键,只含离子键的物质是③⑥;只含共价键的物质是④⑤;既有离子键又共价键的是①⑦;
故答案:③⑥;④⑤;①⑦;
点评 本题考查化学键,把握化学键判断的一般规律、物质中的化学键即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列关于能量转换的认识不正确的是( )
| A. | 电解水生成氢气和氧气时,电能转化为化学能 | |
| B. | 白炽灯工作时,电能全部转化为光能 | |
| C. | 煤燃烧时,化学能主要转化为热能 | |
| D. | 绿色植物的光合作用时,将光能转变为化学能 |
8.下列实验装置能达到实验目的是(夹持仪器未画出)( )
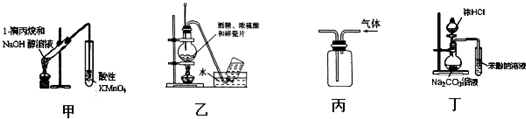

| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
5.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
9.下列关于化学键的说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
9.滴定实验是化学学科中重要的定量实验.请回答下列问题:
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
(1)用酸式滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液.
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
A.NaCl B.NaBr C.NaCN D.Na2CrO4.
Ⅰ.酸碱中和滴定--已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250mL溶液; ②准确量取25.00mL所配溶液于锥形瓶中;③滴加几滴酚酞溶液;④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
| 滴定序号 | 待测液体积 | 所消耗盐酸标准的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 25.00 | 0.50 | 20.60 |
| 2 | 25.00 | 6.00 | 26.00 |
| 3 | 25.00 | 1.10 | 21.00 |
(2)试样中NaOH的质量分数为80%.
(3)若出现下列情况,测定结果偏高的是ce.
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定-取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol•L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4═K2SO4+10CO2↑+2MnSO4+8H2O.
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是滴入最后一滴KMnO4溶液,溶液由无色变为浅紫红色,且半分钟不褪色
Ⅲ.沉淀滴定--滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶.
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是D (填选项字母).
| 难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
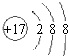
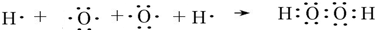
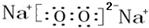 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023