题目内容
20.下列说法正确的是( )| A. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| B. | 物质发生化学变化一定伴随着能量变化,且能量形式只表现为热量变化 | |
| C. | 把石墨完全转化为金刚石时,要吸收能量,所以石墨不如金刚石稳定 | |
| D. | 原子结合成分子的过程一定释放出能量 |
分析 A.中和热是指稀的强酸溶液和稀的强碱溶液发生中和反应,生成1mol水放出的热量;
B.化学反应的实质是旧化学键断裂吸收能量,同时新化学键形成的过程方程能量,所以反应过程中一定伴随能量的变化,但化学反应的能量变化可以是热能、光能、电能等形式的能量变化;
C.根据能量越低越稳定判断;
D.原子结合成分子的过程即新化学键的形成,新键形成一定释放能量.
解答 解:A.1mol硫酸含2mol氢离子和足量强碱反应生成2mol水,因此放出的热量不是中和热,故A错误;
B、化学反应的实质是旧化学键断裂吸收能量,同时新化学键形成的过程方程能量,所以反应过程中一定伴随能量的变化,但化学反应的能量变化可以是热能、光能、电能等形式的能量变化,如镁条燃烧过程中有光能、热能的变化,故B错误;
C.根据能量越低越稳定,石墨完全转化为金刚石时,要吸收能量,则石墨能量比金刚石低,石墨比金刚石稳定,故C错误;
D.原子结合成分子的过程即新化学键的形成,新键形成一定释放能量,故D正确;
故选D.
点评 本题考查较为综合,涉及中和热、化学反应的能量变化等,为高考常见题型,综合考查学生的分析能力和化学科学素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
10.为探究溴乙烷与NaOH的醇溶液共热发生的是水解反应还是消去反应,甲、乙两位同学分别设计如下实验方案:
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应.
乙:向反应混合液中滴入硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应.
则有关上述实验方案的叙述正确的是( )
甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应.
乙:向反应混合液中滴入硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应.
则有关上述实验方案的叙述正确的是( )
| A. | 甲正确 | B. | 乙正确 | C. | 甲、乙均正确 | D. | 甲、乙均不正确 |
11.下列有关化学用语表示正确的是( )
| A. | 次氯酸的电子式 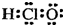 | |
| B. | S2-的结构示意图: | |
| C. | 质子数为92,中子数为143的铀原子:23592U | |
| D. | NH4I的电子式: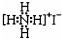 |
8.下列实验装置能达到实验目的是(夹持仪器未画出)( )
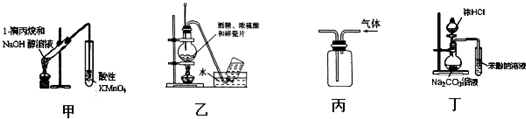

| A. | 用甲装置检验1-溴丙烷消去产物 | |
| B. | 实验室用乙装置制取乙烯 | |
| C. | 用丙装置收集甲烷气体 | |
| D. | 用丁装置证明酸性强弱:盐酸>碳酸>苯酚 |
5.几种短周期元素的原子半径及主要化合价如表:
下列叙述正确的是( )
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性 X<Y | |
| B. | W的氢化物比同族其它元素的氢化物稳定,是因为W的氢化物中存在氢键 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以将Z单质从其氢化物中置换出来 |
9.下列关于化学键的说法正确的是( )
| A. | 含有金属元素的化合物一定是离子化合物 | |
| B. | 第ⅠA族和第ⅦA族原子化合时,一定生成离子键 | |
| C. | 由非金属元素形成的化合物一定不是离子化合物 | |
| D. | 离子化合物中可能同时含有离子键和共价键 |
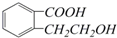 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质: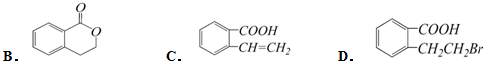
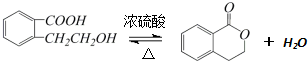 .
.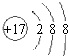
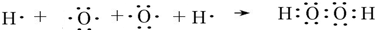
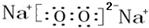 ,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023
,该化合物和B与D形成的某化合物反应的化学方程式为:2Na2O2+2CO2=2Na2CO3+O2,1molH发生该反应转移电子数为6.02×1023