题目内容
根据要求完成下列各小题实验.(a、b为弹簧夹,加热及固定装置已略去)
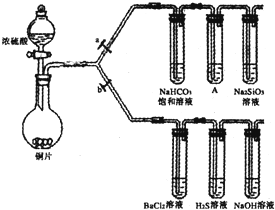
(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①反应原理:铜与浓硫酸反应的化学方程式是 .
②实验步骤:连接仪器、 、加药品后,打开a关闭b,然后滴入浓硫酸,加热.
③试剂选择:装置A中试剂是 .
④结论:能说明碳的非金属性比硅强的实验现象是 .
(2)验证SO2的氧化性、还原性和酸性氧化物的通性.
①在(1)②操作后打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是 .
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
写出其中SO2显示还原性生成沉淀的离子方程式 .

(1)验证碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
①反应原理:铜与浓硫酸反应的化学方程式是
②实验步骤:连接仪器、
③试剂选择:装置A中试剂是
④结论:能说明碳的非金属性比硅强的实验现象是
(2)验证SO2的氧化性、还原性和酸性氧化物的通性.
①在(1)②操作后打开b,关闭a.
②H2S溶液中有浅黄色浑浊出现,化学方程式是
③BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫、水;
②反应生成气体,在加入药品之前需要检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水;
③氯气具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀.
②反应生成气体,在加入药品之前需要检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水;
③氯气具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀.
解答:
解:(1)①铜与浓硫酸反应生成硫酸铜和二氧化硫、水,所以反应方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
②装置A中反应制备气体,在加入药品之前需要检验装置的气密性,故答案为:检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液,
故答案为:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强,
故答案为:A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应离子方程式为:2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,
故答案为:
Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-.
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②装置A中反应制备气体,在加入药品之前需要检验装置的气密性,故答案为:检验装置的气密性;
③装置A的作用是除去二氧化硫,防止干扰二氧化碳与水硅酸钠的反应,可以利用强氧化性物质如:酸性高锰酸钾溶液,
故答案为:酸性高锰酸钾溶液;
④利用强酸制备弱酸,酸性越强,最高价氧化物水化物的酸性越强,中心元素的非金属性越强,A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀,说明碳的非金属性比硅强,
故答案为:A中KMnO4溶液没有完全褪色,盛有Na2SiO3溶液的试管中出现白色沉淀;
(2)②H2S溶液中二氧化硫与硫化氢反应生成硫单质与水,反应离子方程式为:2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O;
③BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,氯水中有氯气分子,氯气分子具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡白色沉淀,反应的方程式为Ba2++SO2+Cl2+2H2O═BaSO4↓+4H++2Cl-,另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀,
故答案为:
| BaSO4 | BaSO3 |
点评:本题考查实验方案的设计,涉及化学用语、物质性质、对装置的理解等,为高频考点,题目难度中等,试题侧重于学生的分析能力和实验能力,理解实验原理是解题的关键,试题有利于培养学生灵活应用所学知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
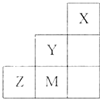

| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
在0.1mol/L的Na2CO3溶液中,下列关系式不正确的是( )
| A、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| B、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L |
下列说法正确的是( )
| A、氯碱工业中,阴极区只需加入水 |
| B、电解熔融氯化铝制取金属铝 |
| C、电镀时,用镀层金属作阳极 |
| D、将钢闸门与外电源正极相连,可防止其腐蚀 |
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则下列说法正确的是( )
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
下列说法正确的是( )
| A、氢氧化钠可用食物调整碱性的添加剂 |
| B、棉、麻完全燃烧可以生成CO2和H2O |
| C、脂肪在一定条件下都能发生水解反应 |
| D、汽油、柴油、煤油的主要成分都是碳氢化合物 |


 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):