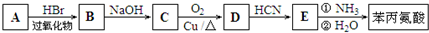题目内容
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则下列说法正确的是( )
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
考点:电解原理
专题:
分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH, 即电解生成了0.1 mol H2SO4 ,并电解了0.1 mol H2O ;
A、根据以上分析,阴极有氢气放出;
B、根据以上分析计算;
C、没有体积无法计算;
D、根据以上分析计算.
A、根据以上分析,阴极有氢气放出;
B、根据以上分析计算;
C、没有体积无法计算;
D、根据以上分析计算.
解答:
解:Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 mol H2O,由电解的总反应式:
2H2O+2CuSO4
2Cu+O2↑+2H2SO4 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
2H2O
2H2↑+O2↑ 转移电子
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
A、根据以上分析,阴极有氢气放出,故A错误;
B、根据以上分析计算,电解过程中共转移电子为0.4 mol,故B正确;
C、没有体积无法计算,故C错误;
D、根据以上分析,阳极收集到的气体体积为(0.05+0.05)×22.4=2.24L,故D错误;
故选:B.
2H2O+2CuSO4
| ||
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
2H2O
| ||
2mol 2mol 1mol 4mol
0.1mol 0.1mol 0.05mol 0.2mol
A、根据以上分析,阴极有氢气放出,故A错误;
B、根据以上分析计算,电解过程中共转移电子为0.4 mol,故B正确;
C、没有体积无法计算,故C错误;
D、根据以上分析,阳极收集到的气体体积为(0.05+0.05)×22.4=2.24L,故D错误;
故选:B.
点评:本题考查电解池的工作原理,先根据出什么加什么判断电解的过程,再根据电解方程式进行计算,难度一般.

练习册系列答案
相关题目
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
| A、一定没有乙烯 |
| B、一定有乙烯 |
| C、一定没有甲烷 |
| D、一定有甲烷 |
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L2mol/LHF溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中,正确的是( )
| A、25℃时,0.1 mol/LHF溶液中pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
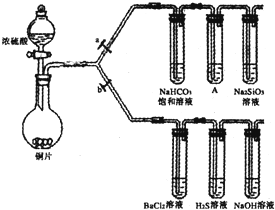
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
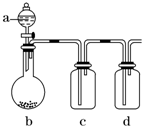

| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |
在可逆反应2A+3B?xC+D中,A、B、C、D均为气态.已知:起始浓度A为5mol?L-1、B为3mol?L-1;C的反应速率为0.5mol?L-1?min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol?L-1,下列关于此反应的说法中,不正确的是( )
| A、平衡浓度A/B=5:3 |
| B、x=2 |
| C、B的平衡浓度为1.5mol?L-1 |
| D、A的转化率为20% |
处于平衡状态的反应2H2S(g)═2H2(g)+S2(g)△H>0,下列说法正确的是( )
| A、若体系恒容,通入H2S(g),则正反应速率增大,逆反应速率减小 |
| B、升高温度,正逆反应速率都增大,H2S分解率也增大 |
| C、增大压强,平衡向逆反应方向移动,将引起体系温度降低 |
| D、若体系恒容,注入一些H2后达新平衡,H2浓度将减小 |
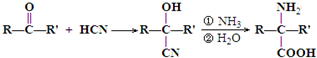
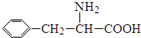 )是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示:
)是合成APM的原料之一.苯丙氨酸的一种合成途径如图所示: