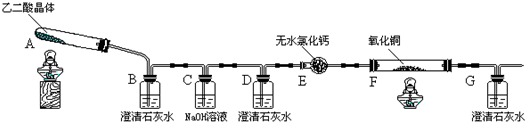
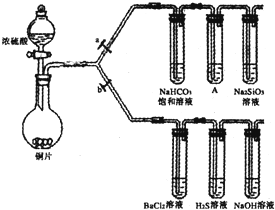
题目内容
在0.1mol/L的Na2CO3溶液中,下列关系式不正确的是( )
| A、c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| B、c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| C、c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) |
| D、c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L |
考点:离子浓度大小的比较
专题:
分析:A、根据电荷守恒判断;
B、根据CO32-的两级水解程度不同判断;
C、根据质子守恒判断;
D、根据元素守恒判断;
B、根据CO32-的两级水解程度不同判断;
C、根据质子守恒判断;
D、根据元素守恒判断;
解答:
解:A、在0.1mol/L的Na2CO3溶液中,根据电荷守恒,有c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故A正确;
B、在0.1mol/L的Na2CO3溶液中,CO32-的一级水解生成HCO3-,二级水解生成H2CO3,在水解的同时都有OH-生成,所以c(OH-)>c(HCO3-),故B错误;
C、根据质子守恒有c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D、根据碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故D正确;
故选B.
B、在0.1mol/L的Na2CO3溶液中,CO32-的一级水解生成HCO3-,二级水解生成H2CO3,在水解的同时都有OH-生成,所以c(OH-)>c(HCO3-),故B错误;
C、根据质子守恒有c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故C正确;
D、根据碳元素守恒可知c(HCO3-)+c(CO32-)+c(H2CO3)=0.1mol/L,故D正确;
故选B.
点评:本题主要考查根据盐类水解后溶液中离子浓度关系,中等难度,解题时注意抓住物料守恒、电荷守恒、质子守恒等几个关系.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
泽熙同学与田中同学争论酸性与碱性食物类别,下列是碱性食物的是( )
| A、西红柿 | B、鸡蛋 |
| C、牛肉 | D、火腿肠 |
体积为1L的某溶液中含有的离子如表所示:用Pt电极电解该溶液,当电路中有3mol电子通过时(忽略电解时溶液体积的变化及电解产物可能存在的溶解现象),下列说法正确的是( )
| 离子 | Cu2+ | Al3+ | NO3- | Cl- |
| 1 | 1 | a | 1 |
| A、阴极析出的金属是铜与铝 |
| B、a=3 |
| C、阳极生成1.5 mol Cl2 |
| D、电解后溶液的pH=0 |
将0.1mol两种气体烃组成的混合气完全燃烧后得3.36L(标况)CO2和3.6g水,对于组成判断正确的是( )
| A、一定没有乙烯 |
| B、一定有乙烯 |
| C、一定没有甲烷 |
| D、一定有甲烷 |
在可逆反应2A+3B?xC+D中,A、B、C、D均为气态.已知:起始浓度A为5mol?L-1、B为3mol?L-1;C的反应速率为0.5mol?L-1?min-1;反应开始至达到平衡需2min,平衡时D的浓度为0.5mol?L-1,下列关于此反应的说法中,不正确的是( )
| A、平衡浓度A/B=5:3 |
| B、x=2 |
| C、B的平衡浓度为1.5mol?L-1 |
| D、A的转化率为20% |