题目内容
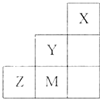
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )

| A、气态氢化物稳定性为:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、ZM2分子中各原子的最外层均满足8电子稳定结构 |
| D、三种元素中,Y的非金属性最强,Y的最高价氧化物的水化物的酸性最强 |
考点:位置结构性质的相互关系应用,元素周期律和元素周期表的综合应用
专题:
分析:图为元素周期表中短周期的一部分,则X是第一周期元素,为He;结合位置关系可知,Y为Y,M为Cl,则Z为S,
A.非金属性越强,其氢化物越稳定;
B.电子层越多,半径越大,具有相同电子排布的离子原子序数大的离子半径小;
C.Z的族序数+成键数=8,则各原子的最外层均满足8电子稳定结构;
D.Y为F,没有正价.
A.非金属性越强,其氢化物越稳定;
B.电子层越多,半径越大,具有相同电子排布的离子原子序数大的离子半径小;
C.Z的族序数+成键数=8,则各原子的最外层均满足8电子稳定结构;
D.Y为F,没有正价.
解答:
解:图为元素周期表中短周期的一部分,则X是第一周期元素,为He;结合位置关系可知,Y为Y,M为Cl,则Z为S,
A.非金属性F>Cl>S,则氢化物的稳定性为Y>M>Z,故A错误;
B.电子层越多,半径越大,具有相同电子排布的离子原子序数大的离子半径小,则离子半径为Z2->M->Y-,故B错误;
C.ZM2分子中,Z的族序数(6)+成键数(2)=8,则各原子的最外层均满足8电子稳定结构,故C正确;
D.Y为F,没有正价,不存在高价氧化物的水化物,而三种元素中,M的最高价氧化物的水化物的酸性最强,故D错误;
故选C.
A.非金属性F>Cl>S,则氢化物的稳定性为Y>M>Z,故A错误;
B.电子层越多,半径越大,具有相同电子排布的离子原子序数大的离子半径小,则离子半径为Z2->M->Y-,故B错误;
C.ZM2分子中,Z的族序数(6)+成键数(2)=8,则各原子的最外层均满足8电子稳定结构,故C正确;
D.Y为F,没有正价,不存在高价氧化物的水化物,而三种元素中,M的最高价氧化物的水化物的酸性最强,故D错误;
故选C.
点评:本题考查位置、结构、性质的关系及应用,为高频考点,把握短周期、元素的位置推断元素为解答的关键,注意元素性质的比较及元素周期律的应用,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
下列反应中水起还原剂作用的是( )
| A、CaO+H2O=Ca(OH)2 | ||||
B、C+H2O(g)
| ||||
| C、2F2+2H2O=4HF+O2 | ||||
| D、3NO2+H2O=2HNO3+NO |
泽熙同学与田中同学争论酸性与碱性食物类别,下列是碱性食物的是( )
| A、西红柿 | B、鸡蛋 |
| C、牛肉 | D、火腿肠 |
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
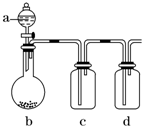

| A、若a为浓硫酸,b为Na2SO3固体,c中盛石蕊溶液,则c中溶液先变红后褪色 |
| B、若a为浓盐酸,b为MnO2,c中盛品红溶液,则c中溶液不褪色 |
| C、若a为醋酸溶液,b为贝壳,c中盛过量澄清石灰水,则c中溶液变浑浊 |
| D、若a为浓氨水,b为生石灰,c中盛AlCl3溶液,则c中产生白色沉淀 |