题目内容
2.运用元素周期律分析下面的推断,其中错误的是( )①113号元素的单质是一种金属,它的氧化物的水化物不能与强碱反应;
②砹(At2)是一种有色固体,HAt很不稳定,AgAt是有色难溶于水的固体;
③硫酸锶是难溶于水和盐酸的固体;
④H2S比水的还原性弱,但H2S比水的稳定性强;
⑤周期表中钠在钾的上方,因此非金属性钠比钾弱,单质的熔点钠也比钾低;
⑥第二周期非金属元素(除稀有气体元素)原子半径小,得电子能力强,其气态氢化物的水溶液均呈酸性.
| A. | ③④⑤⑥ | B. | ④⑤⑥ | C. | ②③④ | D. | ③④⑥ |
分析 ①113号元素为第ⅢA的金属元素;
②砹为ⅤⅡA元素,非金属性较弱;
③第ⅡA元素的硫酸盐中硫酸钙微溶于水,硫酸钡不溶于水;
④非金属性O>S;
⑤金属比较非金属性无意义,碱金属从上到下熔点降低;
⑥氨气的水溶液显碱性.
解答 解:①113号元素为第ⅢA的金属元素,它的氧化物的水化物不能与强碱反应,故正确;
②砹为ⅤⅡA元素,非金属性较弱,则HAt很不稳定,AgAt是有色难溶于水的固体,故正确;
③第ⅡA元素的硫酸盐中硫酸钙微溶于水,硫酸钡不溶于水,则硫酸锶是难溶于水和盐酸的固体,故正确;
④非金属性O>S,硫化氢的稳定性弱于水的,故错误;
⑤金属比较非金属性无意义,金属钠没有非金属性,碱金属从上到下熔点降低,故错误;
⑥氨气的水溶液显碱性,甲烷不溶于水,故错误;
故选B.
点评 本题考查位置、结构与性质关系的应用,为高频考点,把握元素在周期表中位置、元素周期律为解答的关键,试题侧重考查学生的分析、理解能力及灵活应用能力,题目难度不大.

练习册系列答案
相关题目
12.A、B、C、D为可溶于水的四种固体,B的水溶液呈浅绿色,D为含氧酸盐,组成它们的离子有:
Ⅰ.将四种固体溶于水,分别取它们的水溶液进行实验,结果如下:
(1)A溶液的颜色反应为黄色,则A溶液中含有的金属离子是Na+(填离子序号).
(2)将A的水溶液逐滴加入C中,先生成白色沉淀,后白色沉淀逐渐溶解,请写出白色沉淀逐渐溶解的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)B溶液与D溶液反应生成不溶于稀硝酸的白色沉淀,请写出该反应的离子方程式Ba2++SO42-=BaSO4↓.
Ⅱ.(4)据此推断它们是(写化学式)ANaOH;DBa(NO3
)2.
(5)A溶液与B溶液反应的现象为先生成白色絮状沉淀,然后变为灰绿色,最后变为红褐色.
| 阳离子 | Fe2+、Na+、Ba2+、Al3+ |
| 阴离子 | Cl-、SO42-、NO3-、OH- |
(1)A溶液的颜色反应为黄色,则A溶液中含有的金属离子是Na+(填离子序号).
(2)将A的水溶液逐滴加入C中,先生成白色沉淀,后白色沉淀逐渐溶解,请写出白色沉淀逐渐溶解的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(3)B溶液与D溶液反应生成不溶于稀硝酸的白色沉淀,请写出该反应的离子方程式Ba2++SO42-=BaSO4↓.
Ⅱ.(4)据此推断它们是(写化学式)ANaOH;DBa(NO3
)2.
(5)A溶液与B溶液反应的现象为先生成白色絮状沉淀,然后变为灰绿色,最后变为红褐色.
10.硅酸铜钡是当今用最新科学技术才能合成的一种物质.然而现在发现,我国秦朝兵马俑用的一种颜料竟是硅酸铜钡.下列关于硅酸铜钡的学说错误的是( )
| A. | 易溶于水 | B. | 难溶于水 | C. | 属于硅酸盐 | D. | 有颜色 |
17.有关化学键及化合物的说法中,正确的是( )
| A. | 化学键是分子内原子间的相互作用 | |
| B. | 含有阴离子的化合物一定含有阳离子 | |
| C. | 离子化合物熔点一定比共价化合物高 | |
| D. | 非金属元素组成的一定是共价化合物 |
7.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.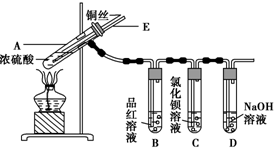
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
写出其中SO2表现还原性的离子反应方程式:SO2+Cl2+2H2O=4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-).
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡.
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收.
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体2.5n mol(不考虑溶解的SO2).

实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡.
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收.
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体2.5n mol(不考虑溶解的SO2).
11.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
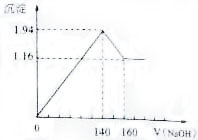 将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;
将一定质量的镁铝合金投入100mL一定浓度的盐酸中,合金完全溶解.向所得溶液中滴加浓度为0.5 mol/L的NaOH溶液,生成的沉淀质量跟加入的NaOH溶液的体积关系如图.(横坐标体积单位是mL,纵坐标质量单位是g)求:(1)合金中Mg,Al的质量;