题目内容
7.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示.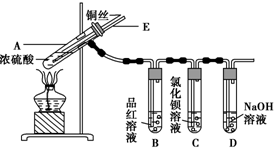
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 |
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡.
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞.为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收.
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体2.5n mol(不考虑溶解的SO2).
分析 探究铜与浓硫酸的反应:A装置铜和浓硫酸反应生成硫酸铜、二氧化硫、和水,B装置利用SO2能使品红溶液褪色的性质来证明Cu与浓硫酸反应产生了SO2气体,C装置盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,D装置吸收尾气.
(1)铜与浓硫酸共热生成硫酸铜、二氧化硫和水,据此写出反应的化学方程式;
(2)SO2能和有色物质反应生成无色物质而具有漂白性,SO2能漂白品红溶液;
(3)SO2具有还原性,能被强氧化剂氧化生成硫酸;SO2属于酸性氧化物,能和碱溶液反应生成亚硫酸盐,亚硫酸盐和BaCl2溶液发生复分解反应,氯水中的Cl2具有氧化性,能将SO2氧化为SO42-,SO42-与Ba2+反应生成BaSO4沉淀;氨水具有碱性,吸收SO2生成SO32-,SO32-与Ba2+反应生成BaSO3沉淀;
(4)A中气体和外界相通,能利用大气压平衡A中压强,防止出现倒吸现象;
(5)SO2有毒,为防止SO2污染空气,应该将装置中气体全部通入NaOH溶液中,需缓慢赶入使SO2被完全吸收;
(6)SO2与Na2S反应,首先是SO2与H2O反应生成H2SO3:SO2+H2O?H2SO3,H2SO3与Na2S反应生成H2S:Na2S+H2SO3=H2S↑+Na2SO3,SO2与H2S反应生成S:2H2S+SO2=3S↓+2H2O,该过程可表示为3SO2+2Na2S=3S↓+2Na2SO3,Na2SO3吸收SO2生成NaHSO3:Na2SO3+SO2+H2O=2NaHSO3,当吸收二氧化硫最多时生成亚硫酸氢钠和S,反应方程式为5SO2+2Na2S+2H2O=3S↓+4NaHSO3,根据二者之间的关系式计算.
解答 解:(1)铜与浓硫酸共热生成硫酸铜、二氧化硫和水,反应方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)SO2能和有色物质反应生成无色物质而具有漂白性,SO2能漂白品红溶液,只要B中溶液褪色就说明铜和浓硫酸发生反应,
故答案为:B试管中品红溶液褪色;
(3)SO2具有还原性,能被强氧化剂氧化生成硫酸,Cl2具有强氧化性,在水溶液里能将SO2氧化为硫酸,硫酸和BaCl2溶液发生复分解反应生成BaSO4,离子方程式为Cl2+SO2+2H2O=4H++2Cl-+SO42-、Ba2++SO42-=BaSO4↓;SO2属于酸性氧化物,能和碱溶液反应生成亚硫酸盐,亚硫酸盐和BaCl2溶液发生复分解反应生成BaSO3,反应方程式为SO2+2NH3+H2O=(NH4)2SO3、SO32-+Ba2+=BaSO3↓,二氧化硫体现还原性的离子反应方程式为SO2+Cl2+2H2O=4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-)
故答案为:BaSO4;BaSO3;SO2+Cl2+2H2O=4H++SO42-+2Cl-(或Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-);
(4)当A中气体压强减小时,外界大气压不变,空气从E进入A,使A中压强平衡,所以B中压强不会产生倒吸,
故答案为:当A试管内气体压强减小时,空气从E导管进入A试管中,维持A试管中压强平衡;
(5)SO2有毒不能直接排空,为防止SO2污染空气,应该将装置中气体全部通入NaOH溶液中,使SO2被完全吸收,其基本操作方法为从E管口向A中缓缓鼓入足量空气,将残留的二氧化硫赶入NaOH溶液中,使其完全被吸收,
故答案为:从E导管口向A试管中缓慢地鼓入足量的空气,将残留的SO2气体赶入NaOH溶液中,使之被完全吸收;
(6)SO2具有氧化性,能和Na2S反应生成S单质,当吸收二氧化硫最多时生成亚硫酸氢钠和S,反应方程式为5SO2+2Na2S+2H2O=3S↓+4NaHSO3,设最多吸收的二氧化硫物质的量为x,
5SO2+2Na2S+2H2O=3S↓+4NaHSO3,
5mol 2mol
x nmol
5mol:2mol=x:nmol
x=$\frac{5mol×nmol}{2mol}$=2.5nmol,
故答案为:2.5n.
点评 本题以浓硫酸和Cu反应为载体考查性质实验方案设计,明确实验原理是解本题关键,侧重考查学生实验操作、分析能力,知道各个装置目的、作用、发生的反应及实验现象,注意化学用语的正确运用,题目难度中等.

 全优点练单元计划系列答案
全优点练单元计划系列答案| 难溶物 | CaF2 | CaC2O4 |
| Ksp | 3.5×10-11 | 2.3×10-9 |
| 酸 | HF | H2C2O4 |
| 电离常数 | Ka=7.2×10-4 | Ka1=5.4×10-2 Ka2=5.4×10-5 |
(2)向0.1mol•L-1的草酸氢钾溶液中滴加NaOH溶液至溶液呈中性,此时溶液中各粒子的浓度关系正确的是ad(填字母).
a.c(K+)=c(HC2O4-)+c(H2C2O4)+c(C2O42-)
b.c(K+)+c(Na+)=c(HC2O4-)+c(C2O42-)
c.cNa+)=c(H2C2O4)+c(C2O42-)
d.c(K+)>cNa+)
(3)在浓度为1mol•L-1的HF与0.01mol•L-1的KHC2O4-混合溶液中逐滴加入1mol•L-1的CaCl2溶液,最初得到的沉淀为CaF2(填化学式).
| A. | 4 mol | B. | 2.5 mol | C. | 2 mol | D. | 0.5 mol |
| A. | 质子数为32 | B. | 质量数为15 | ||
| C. | ${\;}_{15}^{32}$P与${\;}_{15}^{33}$P互为同位素 | D. | 中子数为15 |
| A. | 氕(${\;}_{1}^{1}$H)和氘(${\;}_{1}^{2}$H) | B. | O2和O3 | ||
| C. | 水和冰 | D. | NO和NO2 |
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
| A | B | C |
| D |
| A. | C的非金属性最强,可与E元素形成共价化合物 | |
| B. | 元素D可形成三种价态的酸,且酸根离子均能促进水的电离 | |
| C. | 原子半径由大到小的排列顺序为:E>D>B>A>C | |
| D. | C、D元素形成的最简单的氢化物的热稳定性:D<C |