题目内容
11.短周期主族元素A、B、C、D的原子序数依次增大.已知A、C的原子序数之差为8,A、B、C三种元素原子的最外层电子数之和为15,B元素原子的最外层电子数等于A元素原子的最外层电子数的一半,下列叙述正确的是( )| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | A与C形成的化合物溶于水所得溶液显碱性 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
分析 短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差为8,说明A、C同主族,结合A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半,令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素,以此解答该题.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,A、C的原子序数的差为8,说明A、C同主族,结合A、B、C 三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半,令B的最外层电子数为x,则x+2x+2x=15,解得x=3,再根据短周期元素A、B、C、D,原子序数依次递增,则A为氧元素,B为铝元素,C为硫元素,D为氯元素.
A.A为氧元素,B为铝元素,离子核外电子排布相同,核电荷数越大,离子半径越小,所以离子半径A>B,故A错误;
B.C为硫元素、D为氯元素,非金属性越强,对应的氢化物的稳定性越强,则稳定性D>C,故B错误;
C.A为氧元素、C为硫元素,二者形成的氧化物为二氧化硫、三氧化硫,二氧化硫、三氧化硫溶于水生成亚硫酸、硫酸,溶液呈酸性,故C错误;
D.B为铝元素、D为氯元素,二者形成的化合物是氯化铝,氯化铝是强酸弱碱盐,铝离子水解溶液呈酸性,故D正确.
故选D.
点评 本题考查学生利用原子的结构和位置来推断元素,为高频考点,侧重于学生的分析能力的考查,明确半径、金属性非金属性、最高价氧化物对应水化物的酸性的比较规律.

练习册系列答案
相关题目
1.用铝灰(含有Al2O3、FeO、Fe203和少最SiO2)来的制备碱式硫酸铝[Al2(OH)4SO4],其工艺流程如下:
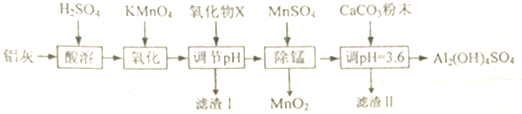
已知:生成氢氧化物沉淀的pH
(1)X为氧化铝,滤渣I的主要成分是二氧化硅和氢氧化铁,MnS04在“除锰”中的作用是还原剂
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.

已知:生成氢氧化物沉淀的pH
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
(2)设计一个简单的实验,证明上述流程中铁元素已被沉淀完全取第一次调节PH后的清液于试管中,滴加硫氰化钾溶液,若溶液呈血红色,说明沉淀不完全,反之沉淀完全
(3)写出第一次调节pH的范围[2.8,3.4),第二次调节pH时,若溶液的pH偏高,将会导致溶液中铝元素的含量降低
(4)加入CaC03制备碱式硫酸铝的化学方程式为Al2(SO4)3+2CaC03+2H2O=Al2(OH)4SO4+2CaSO4+2C02↑.
19.丙烯酸(CH2=CH-COOH)可发生的化学反应类型有( )
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
①加成 ②氧化 ③酯化 ④加聚 ⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | 只有①③④ | D. | 全部 |
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
3.下列过程不涉及化学变化的是( )
| A. | 高炉炼铁 | B. | 海水蒸馏 | C. | 石油裂解 | D. | 煤的干馏 |
20. 我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
 我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )
我国成功研制出新型“海水电池”.电池反应为4Al+3O2+6H2O═4Al(OH)3.下列关于该电池的说法不正确的是( )| A. | 铝片作负极 | |
| B. | 海水作为电解质溶液 | |
| C. | 电池工作时O2得到电子 | |
| D. | 电池工作时实现了电能向化学能的转化 |