题目内容
17.有关化学键及化合物的说法中,正确的是( )| A. | 化学键是分子内原子间的相互作用 | |
| B. | 含有阴离子的化合物一定含有阳离子 | |
| C. | 离子化合物熔点一定比共价化合物高 | |
| D. | 非金属元素组成的一定是共价化合物 |
分析 相邻原子间强烈的相互作用是化学键,离子化合物中一定含有离子键,可能含有共价键,共价化合物中只含共价键.
解答 解:A.相邻原子间强烈的相互作用是化学键,故A错误;
B.、含有阴离子的化合物一定含有阳离子,因为物质呈电中性,故B正确;
C.离子化合物的熔点不一定比共价化合物的熔点高,如二氧化硅的熔点大于NaCl的,故C错误;
D.氯化铵是由非金属元素组成的物质,故D错误;
故选:B.
点评 本题考查化学键,熟悉化学键形成的一般规律及常见物质中的化学键即可解答,并注意利用实例来解答,注意从分子结构是否对称判断分子的极性,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.现有:①0.1mol•L-1醋酸溶液,②0.1mol•L-1盐酸,③pH=1的醋酸溶液.分别加水稀释,使体积变为原来的10倍.对于稀释前后溶液的有关说法错误的是[说明:pH=-lgc(H+)]( )
| A. | 稀释前,溶液pH:①>②=③ | |
| B. | 稀释后,溶液pH:①>②=③ | |
| C. | 稀释前,溶液中溶质的物质的量浓度:③>①=② | |
| D. | 稀释后,溶液中溶质的物质的量浓度:③>①=② |
8.短周期元素X的气态氢化物的化学式为H2X,X所在的族是( )
| A. | ⅡA族 | B. | ⅣA族 | C. | Ⅵ族 | D. | ⅥA族 |
5.NA表示阿伏伽德罗常数的数值,下列判断正确的是( )
| A. | 25℃时,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温下,21gC3H6和C4H8的混合物中含有的碳原子数为1.5NA | |
| C. | 46g乙醇中含有C-H键的数目为6NA | |
| D. | 常温下,2.7g金属铝与足量浓度为18mol/L的浓硫酸反应时转移的电子数为0.3NA |
6.W、X、Y、Z是原子序数依次增大的短周期主族元素.W的气态氢化物的水溶液显碱性,X和Y同主族,Y元素的最高化合价为最低化合价的绝对值的3倍.下列说法错误的是( )
| A. | 阴离子的还原性:Y>X | |
| B. | Y和Z的简单阴离子都会破坏水的电离平衡 | |
| C. | 最高价氧化物的水化物的酸性:Z>Y | |
| D. | 氢化物的热稳定性:W>X |
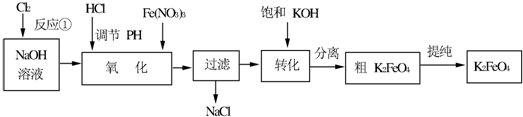

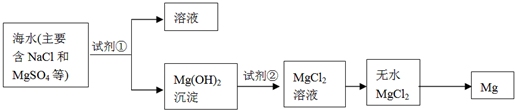


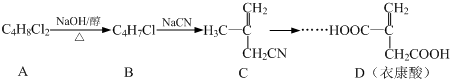
 .
. .
.