题目内容
3.下列各组粒子在指定条件下的溶液中一定能大量共存的一组是( )| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
分析 A.Fe3+在pH为4.4左右沉淀完全;
B.发生氧化还原反应;
C.常温下由水电离出的c(H+)?c(OH-)=10-20的溶液,为酸或碱溶液;
D.该组离子之间不反应,且离子浓度相同时遵循电荷守恒.
解答 解:A.Fe3+在pH为4.4左右沉淀完全,则中性溶液中不能大量存在Fe3+,故A错误;
B.KMnO4、CH3CH2OH发生氧化还原反应,不能大量共存,故B错误;
C.常温下由水电离出的c(H+)?c(OH-)=10-20的溶液,为酸或碱溶液,酸溶液中不能大量存在SiO32-,碱溶液中不能大量存在NH4+,故C错误;
D.该组离子之间不反应,且离子浓度相同时遵循电荷守恒,可大量共存,故D正确;
故选D.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
13.室温下,下列溶液等体积混合后pH一定大于7的是( )
| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
14.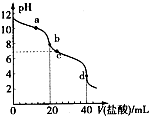 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |
11.把5molA和6molB的混合气体通入4L的密闭容器中,在一定条件下发生如下反应:5A(g)+4B(g)?6C(g)+xD(g),经过5min后反应达到平衡状态时,生成3mol C,并测得D的平均反应速率为0.1mol•L-1•min-1.下列计算结果正确的是( )
| A. | x的数值是2 | |
| B. | A的转化率为50% | |
| C. | B的平衡浓度为2mol/L | |
| D. | 反应前后混合气体的压强之比为22:25 |
8.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 往蔗糖与稀硫酸共热后的溶液中滴加银氨溶液,再水浴加热,能看到银镜生成 | |
| C. | 淀粉和纤维素的分子式均为(C6H10O5)n,二者互为同分异构体 | |
| D. | 向鸡蛋清溶液中加硫酸铵饱和溶液,有沉淀析出,再加水沉淀溶解 |
15.用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有四个峰,峰面积之比是1:1:2:6,则该化合物的结构简式为( )
| A. | CH3OCH2CH2CH3 | B. | CH3CH(OH)CH2CH3 | C. | (CH3)2CHCH2OH | D. | CH3CH2CH2CH2OH |
12.现有室温下的四种溶液,其pH如表所示,下列有关叙述不正确的是( )
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 若①②③④四种溶液等体积混合,混合液pH=7,则混合液中c(NH4+)=c(CH3COO-) | |
| B. | ①④两溶液等体积混合,混合液中c(H+)>c(OH-) | |
| C. | ①③溶液中水的电离程度相等 | |
| D. | V1L②和V2L④溶液混合后溶液pH=9,则V1=$\frac{11}{9}$V2 |
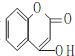 )的路线如下图所示:
)的路线如下图所示: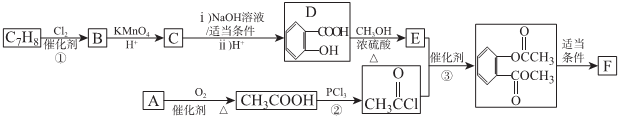
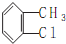 .
.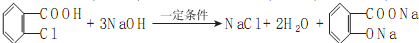 .
.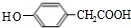 .
.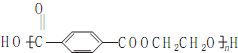 ),参照A→乙酸的表示方法,写出相应的合成路线图
),参照A→乙酸的表示方法,写出相应的合成路线图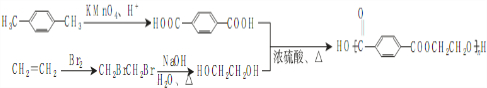 .
.