题目内容
12.现有室温下的四种溶液,其pH如表所示,下列有关叙述不正确的是( )| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | 若①②③④四种溶液等体积混合,混合液pH=7,则混合液中c(NH4+)=c(CH3COO-) | |
| B. | ①④两溶液等体积混合,混合液中c(H+)>c(OH-) | |
| C. | ①③溶液中水的电离程度相等 | |
| D. | V1L②和V2L④溶液混合后溶液pH=9,则V1=$\frac{11}{9}$V2 |
分析 A、四种溶液等体积混合,则NaOH与HCl恰好完全反应生成NaCl和水,根据电荷守恒来回答;
B、①④两溶液等体积混合后过量的NH3•H2O电离使溶液呈碱性;
C、①③两溶液中NH3•H2O电离出的OH-浓度与醋酸电离出的H+浓度相等;
D、②中c(OH-)=10-4mol•L-1,④中c(H+)=10-4mol•L-1,二者混合溶液的pH=9,则混合液中c(OH-)=10-5mol•L-1,然后进行计算即可.
解答 解:A、①②③④四种溶液等体积混合,则NaOH与HCl恰好完全反应生成NaCl和水,根据电荷守恒,可得c(NH4+)+c(H+)+c(Na+)=c(Cl-)+c(OH-)+c(CH3COO-),混合液pH=7,则c(H+)=c(OH-),又c(Na+)=c(Cl-),则c(NH4+)=c(CH3COO-),故A正确;
B、①④两溶液等体积混合,由于NH3•H2O为弱碱,盐酸为强酸,NH3•H2O电离出的OH-浓度与盐酸电离出的H+浓度相等,则NH3•H2O的浓度远大于盐酸,二者混合后过量的NH3•H2O电离使溶液呈碱性,则c(OH-)>c(H+),故B错误;
C、①③两溶液中NH3•H2O电离出的OH-浓度与醋酸电离出的H+浓度相等,则水的电离程度相等,故C正确;
D、②中c(OH-)=10-4mol•L-1,④中c(H+)=10-4mol•L-1,二者混合溶液的pH=9,则混合液中c(OH-)=10-5mol•L-1,因此有10-4mol•L-1×V1L-10-4mol•L-1×V2L=10-5mol•L-1×(V1L+V2L),可得V1=$\frac{11}{9}$V2,故D正确.
故选B.
点评 本题考查弱电解质的电离、酸碱混合溶液定性判断等知识点,根据弱电解质的特点、酸碱混合溶液氢离子浓度的计算方法分析解答,难度中等.

| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |

| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(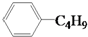 )互为同分异构体 )互为同分异构体 |
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g)$?_{180℃-200℃}^{50-80℃}$Ni(CO)4(g).利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是CD(填字母编号).
A.把温度由80℃升高到180℃,正反应速率减小,逆反应速率增大
B.反应达到平衡后,充入Ni(CO)4(g)再次达到平衡时,$\frac{n[Ni(CO)_{4}]}{{n}^{4}(CO)}$减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当容器中混合气体密度不变时,可说明反应已达化学平衡状态
(2)图1所示的直形石英玻璃封管中充有CO气体,在温度为T1的一端放置不纯的镍(Ni)粉,Ni粉中的杂质不与CO(g)发生反应.在温度为T2的一端得到了纯净的高纯镍,则温度T1<T2(填“>”“<”或“=”).上述反应体系中循环使用的物质是CO.
(3)甲醇是一种重要的化工原料,工业上可用CO和H2合成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ•mol-1.若在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol CO、 2mol H2 | 1mol CH3OH | 2mol CO、 4mol H2 |
| CH3OH的浓度/mol•L-1 | c1 | c2 | c3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 反应物转化率 | α1 | α2 | α3 |
a.c1=c2 b.2Q1=Q3 c.Q1+Q2=90.8 d.α2+α3<100%
(4)据研究,上述(3)中合成甲醇反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是Cu2O+CO?2Cu+CO2(用化学方程式表示).
(5)已知在常温常压下:甲醇的燃烧热为725.8kJ•mol-1,CO的燃烧热为283kJ•mol-1,H2O(g)═H2O(l)△H=-44.0kJ•mol-1.写出甲醇不完全燃烧生成一氧化碳和水蒸气的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ•mol-1.

(6)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳.如图2是四种金属氧化物(Cr2O3、SnO-1、PbO2、Cu2O)被一氧化碳还原时lg$\frac{c(CO)}{c(C{O}_{2})}$与温度(t)的关系曲线图.四个反应中属于吸热反应的是Cr2O3、SnO2(填金属氧化物的化学式),在700℃用一氧化碳还原Cr2O3时,若反应方程式化学计量数为最简整数比,该反应的平衡常数(K)数值等于10-12.
| A. | 钾和镁的次外层电子数 | |
| B. | 等质量的乙烯和丙烯中含有的共用电子对数 | |
| C. | 等体积的CO和NO含有的原子数 | |
| D. | 等物质的量的钠分别在常温下和点燃条件下与氧气反应转移的电子数 |
 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.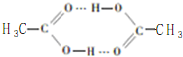
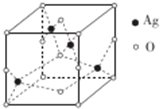
 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
;
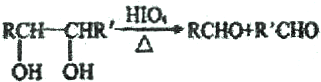 .
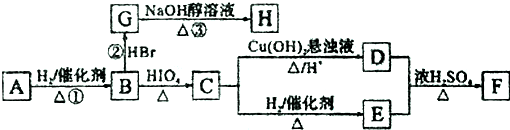
.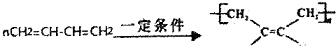 ,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O.
,若H分子中所有碳原子均在一条直线上,则G转化为H的化学方程式为CH3CHBrCHBrCH3+2NaOH$→_{△}^{醇}$H3CC≡CCH3↑+2NaBr+2H2O. .
.