题目内容
15.用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有四个峰,峰面积之比是1:1:2:6,则该化合物的结构简式为( )| A. | CH3OCH2CH2CH3 | B. | CH3CH(OH)CH2CH3 | C. | (CH3)2CHCH2OH | D. | CH3CH2CH2CH2OH |
分析 核磁共振氢谱图中显示三种峰且面积之比为1:1:2:6,说明该有机物分子中含有4种等效氢原子,且氢原子数目之比为1:1:2:6,据此写出该有机物的结构简式.
解答 解:核磁共振氢谱图中显示三种峰且面积之比为1:1:2:6,说明该有机物分子中含有4种等效氢原子,且氢原子数目之比为1:1:2:6,满足该条件的一氯戊烷的结构简式为:(CH3)2CHCH2OH,故选C.
点评 本题考查核磁共振氢谱,难度不大,清楚核磁共振氢谱中峰值数等于有机物中氢原子的种类数.

练习册系列答案
相关题目
5.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )


| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7mol Br2完全反应 |
3.下列各组粒子在指定条件下的溶液中一定能大量共存的一组是( )
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
10.分子式为C3H6O2的有机物有多种同分异构体,现有其中的四种X、Y、Z、W,它们的分子中均含甲基,将它们分别进行下列实验以鉴别,其实验记录如下:
回答下列问题:
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式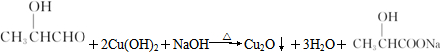 .
.
②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 悬浊液 | 金属钠 | |
| X | 中和反应 | 无现象 | 溶解 | 产生氢气 |
| Y | 无现象 | 有银镜 | 加热后有砖红色沉淀 | 产生氢气 |
| Z | 水解反应 | 有银镜 | 加热后有砖红色沉淀 | 无现象 |
| W | 水解反应 | 无现象 | 无现象 | 无现象 |
(1)写出四种物质的结构简式X:CH3CH2COOH,Y:CH3CHOHCHO,Z:HCOOCH2CH3,W:CH3COOCH3.
(2)①Y与新制Cu(OH)2悬浊液反应的化学方程式
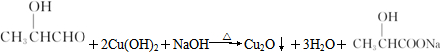 .
.②Z与NaOH溶液反应的化学方程式HCOOCH2CH3+NaOH$\stackrel{△}{→}$HCOONa+CH3CH2OH.
20.柠檬烯是一种食用香料,其结构简式如图所示,有关柠檬烯的分析正确的是( )

| A. | 它的一氯代物有9种(不考虑立体异构) | |
| B. | 它的分子中最多有7个原子共平面 | |
| C. | 一定条件下,它分别可以发生加成、取代、氧化、还原反应 | |
| D. | 它和丁基苯(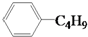 )互为同分异构体 )互为同分异构体 |
7.化学与生活、社会可持续发展密切相关.下列有关叙述不正确的是( )
| A. | 黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质 | |
| B. | “煤改气”“煤改电”等清洁燃料改造工程有利于减少雾霾天气 | |
| C. | 利用二氧化碳等原料合成聚碳酸酯类可降解塑料,有利于减少白色污染 | |
| D. | 焰火的五彩缤纷是某些金属元素化学性质的展现 |
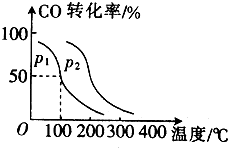 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气. 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
; .
.