题目内容
14.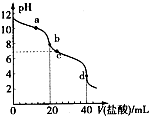 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )
常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14.混合溶液的pH与盐酸体积V的关系如图所示.下列说法正确的是( )| A. | a点:c(CI-)>c(M+)>(OH-)>c(H+) | |
| B. | b点:MOH和HCl恰好完全反应 | |
| C. | c点:c(H+)=c(OH-)+c(MOH) | |
| D. | a点到d点:水电离的c(H+)•c(OH-)先变大,后变小 |
分析 常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14,则盐酸中氢离子浓度与MOH中氢氧根离子浓度相等,由于盐酸为强酸,且加入20mL盐酸时溶液呈碱性,说明MOH为弱碱,则MOH的浓度大于盐酸,
A.a点时溶液呈碱性,加入盐酸不足,结合电荷守恒判断;
B.b点时MOH的物质的量大于盐酸;
C.c点溶液的pH=7,则c(H+)=c(OH-);
D.a点到d点的过程中,溶液从碱性到中性,然后盐酸过量,溶液又呈酸性,水的电离程度先增大后减小,据此判断水电离的c(H+)•c(OH-)的变化.
解答 解:常温下,用pH=m的盐酸滴定20mlpH=n的MOH溶液,且m+n=14,则盐酸中氢离子浓度与MOH中氢氧根离子浓度相等,由于盐酸为强酸,且加入20mL盐酸时溶液呈碱性,说明MOH为弱碱,则MOH的浓度大于盐酸,
A.a点溶液为碱性,则c(OH-)>c(H+),根据电荷守恒可知c(M+)>c(Cl-),溶液中正确的离子浓度大小为:c(M+)>c(Cl-)>c(OH-)>c(H+),故A错误;
B.根据图象可知,b点加入20mLHCl溶液时,由于盐酸的浓度小于MOH,则MOH过量,此时MOH没有完全反应,故B错误;
C.c点溶液的pH=7,呈中性,则溶液中一定满足:c(H+)=c(OH-),故C错误;
D.a点MOH过量,溶液呈碱性,抑制了水的电离,之后随着盐酸体积的增大,溶液中氢氧根离子浓度减小,水的电离程度最大,当MOH和HCl恰好反应时水的电离程度最大,d点盐酸过量溶液呈酸性,抑制了水的电离,所以a点到d点,水电离的c(H+)•c(OH-)先变大,后变小,故D正确;
故选D.
点评 本题考查了溶液酸碱性与溶液pH的计算,题目难度中等,根据图象曲线变化正确判断MOH为弱碱为解答关键,注意掌握溶液酸碱性与溶液pH的关系,试题培养了学生的分析能力及灵活应用能力.

 名校课堂系列答案
名校课堂系列答案 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.

| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7mol Br2完全反应 |
| A. | 食用油脂饱和程度越大,熔点越高 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 纯铁易被腐蚀,可以在纯铁中混入碳元素制成“生铁”,以提高其抗腐蚀能力 | |
| D. | 光纤通信是现代化的通信手段,光导纤维的主要成分是晶体硅 |
| A. | 二氧化锰具有强氧化性,可作双氧水分解的氧化剂 | |
| B. | 浓硫酸具有较强酸性,常用作淀粉水解的催化剂 | |
| C. | 碳具有还原性,一定条件下能将二氧化硅还原为硅 | |
| D. | 二氧化硫具有漂白性,与氯水混合使用效果更好 |
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.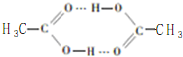
 随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气.
随着国际油价不断攀升,合成CH3OH替代汽油的研究成为热点.工业上常用天然气制备合成CH3OH的原料气. 已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空:
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大.A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族. E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满.根据以上信息填空: ,F原子的电子排布式是1s22s22p63s23p63d104s1;
,F原子的电子排布式是1s22s22p63s23p63d104s1; ;
;