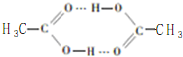题目内容
13.室温下,下列溶液等体积混合后pH一定大于7的是( )| A. | pH=3的醋酸与pH=11的氢氧化钾 | |
| B. | 0.1 mol/L的盐酸与0.1 mol/L的氨水 | |
| C. | 0.001 mol/L的盐酸与pH=11的氨水 | |
| D. | pH=3的盐酸与0.001 mol/L的氨水 |
分析 A.醋酸为弱酸,混合液中醋酸过量,溶液呈酸性,溶液的pH小于7;
B.二者恰好反应生成氯化铵,铵根离子部分水解,溶液呈酸性,溶液的pH小于7;
C.氨水为弱碱,混合液中氨水过量,溶液呈碱性,溶液的pH大于7;
D.pH=3的盐酸中氢离子浓度为0.001mol/L,二者恰好反应生成氯化铵,溶液呈酸性.
解答 解:常温下溶液的pH一定大于7,则反应后溶液呈碱性,
A.pH=3的醋酸与pH=11的氢氧化钾溶液等体积反应,由于醋酸为弱酸,pH=3的溶液中氢离子浓度为0.001mol/L,醋酸的浓度大于0.001mol/L,则混合液中醋酸过量,反应后溶液呈酸性,故A错误;
B.0.1 mol/L的盐酸与0.1 mol/L的氨水等体积混合,二者恰好反应生成强酸弱碱盐氯化铵,溶液呈酸性,故B错误;
C.氨水为弱碱,0.001 mol/L的盐酸与pH=11的氨水等体积混合,氨水过量,溶液一定呈碱性,故C正确;
D.pH=3的盐酸的浓度为0.001mol/L,与0.001 mol/L的氨水等体积反应后,恰好生成氯化铵,溶液呈酸性,故D错误;
故选C.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握弱电解质的电离特点,试题培养了学生的分析能力及灵活应用基础知识的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(1)如图所示A的pH范围使用的指示剂是酚酞;
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
 (酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.
(酸碱中和滴定是利用中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的实验方法,其中溶液的pH变化是判断滴定终点的依据.| 实验 序号 | 消耗0.1000mol•L-1的 盐酸溶液的体积/mL | 待测氢氧化钠 溶液的体积/mL |
| 1 | 29.02 | 25.00 |
| 2 | 28.01 | 25.00 |
| 3 | 27.99 | 25.00 |
(2)用0.1000mol•L-1的盐酸溶液滴定未知浓度的氢氧化钠溶液,重复三次的实验数据如表所示.则待测氢氧化钠的物质的量浓度是0.1120mol•L-1.在上述滴定过程中,若滴定前滴定管下端尖嘴中有气泡,滴定后气泡消失,则测定结果将偏高(填“偏高”、“偏低”或“不影响”).
(3)下列关于上述中和滴定过程中的操作正确的是AC(填序号)
A.用碱式滴定管量取未知浓度的烧碱溶液
B.滴定管和锥形瓶都必须用待盛放液润洗
C.滴定中始终注视锥形瓶中溶液颜色变化
D.锥形瓶中的待测液可用量筒量取.
1.下列说法不正确的是( )
| A. | 二甲苯和四甲苯均有三种 | |
| B. | 利用核磁共振氢谱可以鉴别1-丙醇和2-丙醇 | |
| C. | 溴苯水解后,滴加硝酸酸化的硝酸银溶液检验水解产物中的溴离子 | |
| D. | 石油裂解和油脂皂化均是由高分子物质生成小分子物质的过程 |
8.在Na2O2与水反应中,叙述正确的是( )
| A. | O2是还原产物 | B. | Na2O2是氧化剂,水是还原剂 | ||
| C. | NaOH是氧化产物 | D. | Na2O2中,氧既得电子,又失电子 |
18.甲、乙两种金属:①甲比乙容易与H2O反应;②甲单质能与乙的阳离子发生置换反应;③甲的最高价氧化物的水化物碱性比乙的最高价氧化物的水化物碱性强;④与某非金属反应时,甲原子失去的电子数目比乙多;⑤甲与乙作为电极材料,盐酸做电解质溶液构成原电池,甲为正极.能说明甲比乙的金属性强的是( )
| A. | ①③④ | B. | ①③④⑤ | C. | ①②③ | D. | ①②③④ |
5.天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( )


| A. | 分子中的官能团有羟基、碳碳双键、醚键、酯基 | |
| B. | 若R为乙基则该物质的分子式可以表示为C16H14O7 | |
| C. | lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol | |
| D. | lmol该化合物最多可与7mol Br2完全反应 |
3.下列各组粒子在指定条件下的溶液中一定能大量共存的一组是( )
| A. | 中性的透明溶液中:K+、SO42-、NO3-、Fe3+ | |
| B. | 在KMnO4溶液中:SO42-、Mg2+、NO3-、CH3CH2OH | |
| C. | 常温下由水电离出的c(H+)?c(OH-)=10-20的溶液中:Na+、NH4+、Cl-、SiO32- | |
| D. | 离子物质的量浓度相同的溶液中:CH3COO-、SO42-、NH4+、Cu2+ |
 乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备:
乙烯酮是最简单的烯酮,其分子式为CH2=C=O,是一种重要的有机中间体,可由乙酸分子内脱水得到,也可通过下列反应制备: ),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.
),二聚乙烯酮分子中含有的σ键与π键的数目之比为5:1.