题目内容
19.现将足量的浓硝酸与铜反应,生成4.48L的NO2气体(标况下),求:(1)参加反应的铜的质量;
(2)被还原的硝酸的物质的量;
(3)将得到的溶液稀释到500mL,求溶液中Cu(NO3)2的物质的量浓度.
分析 发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,n(NO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由反应可知,生成二氧化氮对应的硝酸作氧化剂被还原,结合反应及c=$\frac{n}{V}$计算.
解答 解:(1)n(NO2)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由电子守恒可知,n(Cu)=$\frac{0.2mol×(5-4)}{(2-0)}$=0.1mol,其质量为0.1mol×64g/mol=6.4g,
答:参加反应的铜的质量为6.4g;
(2)由反应可知,生成二氧化氮对应的硝酸作氧化剂被还原,由N原子守恒可知,被还原的硝酸的物质的量为0.2mol,
答:被还原的硝酸的物质的量为0.2mol;
(3)由Cu原子守恒可知,n[Cu(NO3)2]=0.1mol,则溶液中Cu(NO3)2的物质的量浓度为$\frac{0.1mol}{0.5L}$=0.2mol/L,
答:溶液中Cu(NO3)2的物质的量浓度为0.2mol/L.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、电子及原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
相关题目
16.青蒿素是抗疟特效药属于萜类化合物,如图所示有机物也属于萜类化合物,下列叙述正确的是( )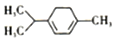

| A. | 该物质属于芳香族化合物,难溶于水 | |
| B. | 该物质可以发生消去、氧化、取代等反应 | |
| C. | 该分子结构中所有碳原子可能共平面 | |
| D. | 该有机物的一氯取代物有7种(不含立体结构) |
17.欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
| 制备气体 | X(除杂试剂) | Y (检验试剂) | 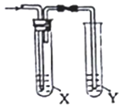 | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 | |
| B | 电石与NaCl水溶液 | H2O | Br2的CCl4溶液 | |
| C | C2H5OH与浓硫酸 加热至170℃ | 饱和NaHSO3 溶液 | K2Cr2O7酸性溶液 | |
| D | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 |
| A. | A | B. | B | C. | C | D. | D |
7.Ⅰ.某同学探究铝与盐酸反应的速率变化,有关实验数据记录如下:
(1)反应速率最大的时间段(即0~1、1~2、2~3、3~4、4~5min)是2~3.
(2)他觉得该实验反应速率快,不方便测量氢气体积,欲在盐酸溶液中加入适量下列溶液以减慢反应速率:A.蒸馏水.B.NaCl溶液.C.NaNO3溶液,你认为不可行的是C,原因生成NO气体,影响生成氢气的量.
Ⅱ.某学习小组设计了下列实验验证元素周期律:在a、b、c、d四只烧杯里分别加入适量冷水,分别滴加几滴酚酞溶液,依次加入大小相近的Na、Mg、Al、K金属块,观察现象.
(3)金属元素性变化规律:同主族从上到下逐渐增强:同周期从左到右逐渐减弱;
(4)反应最剧烈的烧杯里的金属是d(填字母)a.钠b.镁c.铝d.钾;
(5)a烧杯里发生反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑;
(6)实验中发现b、c两只烧杯里无现象,若想达实现实验目的,请你帮助选择下列合适的方法BC.
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液.
| 反应时间(min) | 1 | 2 | 3 | 4 | 5 |
| 生成氢气体积(ml) | 50 | 150 | 300 | 380 | 410 |
(2)他觉得该实验反应速率快,不方便测量氢气体积,欲在盐酸溶液中加入适量下列溶液以减慢反应速率:A.蒸馏水.B.NaCl溶液.C.NaNO3溶液,你认为不可行的是C,原因生成NO气体,影响生成氢气的量.
Ⅱ.某学习小组设计了下列实验验证元素周期律:在a、b、c、d四只烧杯里分别加入适量冷水,分别滴加几滴酚酞溶液,依次加入大小相近的Na、Mg、Al、K金属块,观察现象.
(3)金属元素性变化规律:同主族从上到下逐渐增强:同周期从左到右逐渐减弱;
(4)反应最剧烈的烧杯里的金属是d(填字母)a.钠b.镁c.铝d.钾;
(5)a烧杯里发生反应的离子方程式是2Na+2H2O=2Na++2OH-+H2↑;
(6)实验中发现b、c两只烧杯里无现象,若想达实现实验目的,请你帮助选择下列合适的方法BC.
A.把镁、铝的金属块换成金属粉末
B.把烧杯中的冷水换成热水
C.把烧杯中的冷水换成盐酸
D.把烧杯中的冷水换成氢氧化钠溶液.
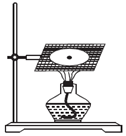 某化学实验小组拟用如图装置进行钠与氧气反应的实验.
某化学实验小组拟用如图装置进行钠与氧气反应的实验.