题目内容
11. A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C
A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去).A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C(1)若A是一种黄色单质固体,则B→C的化学方程式为2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3.
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为过氧化钠.等物质的量的B和C中所含离子的物质的量相等(填写“相等”或“不相等”).将15.6gC和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入HCl气体6.72L(标准状况),若忽略反应过程中溶液的体积变化,则反应过程中得到(标准状况)的气体8.96L;最终得到的溶液中NaCl的物质的量浓度为1.5mol/L.
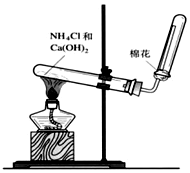
(3)若A是一种能用如图装置制取的气体,请结合所学知识,回答下列问题:
①写出实验室制取A的化学方程式Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
②收集A的方法是向下排空气法,验证A是否已经收集满的方法是:将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满(任写一种).
③若有5.35g氯化铵参加反应,则产生的A气体在标准状况下的体积为2.24L.
分析 根据题中各物质转化关系,A能发生连续氧化,
(1)A是一种黄色单质固体,应为S,则B为SO2,C为SO3,生成H2SO4;
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,生成NaOH;15.6gNa2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl;
(3)①实验室制取氨气是利用氯化铵和氢氧化钙加热反应生成氯化钙、氨气和水;
②氨气是易溶于水比空气轻的气体,据此选择收集方法,检验氨气的方法是利用氨气溶于水溶液显碱性,使湿润的红色石蕊试纸变蓝色或遇到浓盐酸形成白色烟;
③依据氮元素守恒计算.
解答 解:(1)A是一种黄色单质固体,应为S,则B为SO2,C为SO3,SO2在催化剂条件下生成SO3,反应的方程式为2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3,
故答案为:2SO2+O2 $\frac{\underline{催化剂}}{△}$2SO3;
(2)A是一种活泼金属,C是淡黄色固体,则A为Na,B为Na2O,C为Na2O2,Na2O2中阳离子与阴离子数之比为2:1,等物质的量的B和C中所含离子的物质的量相等,15.6gNa2O2的物质的量为$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,氧气0.1mol,标准状况下为2.24L,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,过氧化钠与水反应生成氧气为0.2mol×$\frac{1}{2}$=0.1mol,铝与氢氧化钠反应生成氢气为0.2mol×$\frac{3}{2}$=0.3mol,故生成氢气的体积为(0.1mol+0.3mol)×22.4L/mol=8.96L,由氯元素守恒可知反应后生成0.3molNaCl,则浓度为$\frac{0.3mol}{0.2L}$=1.5mol/L,
故答案为:相等;8.96;1.5mol/L;
(3)①实验室制取氨气是利用氯化铵和氢氧化钙加热反应生成氯化钙、氨气和水,反应的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
②氨气是易溶于水比空气轻的气体,据此选择收集方法为向下排空气法收集,检验氨气的方法是利用氨气溶于水溶液显碱性,使湿润的红色石蕊试纸变蓝色或遇到浓盐酸形成白色烟,具体方法为:
将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满
故答案为:向下排空气法;将湿润的红色石蕊试纸置于试管口处,若试纸变蓝,则证明氨气已收集满或用蘸有浓盐酸的玻璃棒靠近试管口处,若产生大量白烟,则证明氨气已收集满;
③若有5.35g氯化铵参加反应,物质的量n=$\frac{5.35g}{53.5g/mol}$=0.1mol,Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,生成氨气物质的量为0.1mol,则产生的A气体在标准状况下的体积为0.1mol×22.4L/mol=2.24L,
故答案为:2.24.
点评 本题考查无机物的推断,题目难度中等,本题注意根据物质的颜色判断物质的可能性,注意反应特征现象和物质特征性质的掌握.

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案| A. | 0.40mol | B. | 0.50mol | C. | 0.60mol | D. | 0.70mol |
| 编号 | 温度(℃) | 起始/mol | 平衡/mol | 达到平衡 所需时间/s | |
| PCl5(g) | PCl3(g) | Cl2(g) | |||
| Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
| Ⅱ | 320 | 0.80 | t2 | ||
| Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
| A. | 平衡常数K:容器Ⅱ>容器Ⅲ | |
| B. | 反应到达平衡时,PCl5的转化率:容器Ⅱ>容器Ⅰ | |
| C. | 反应到达平衡时,容器I中的平均速率为v(PCl5)=0.1/t1 mol•L-1•s-1 | |
| D. | 容器Ⅲ中平衡后,等温条件下充入一定量He,平衡不发生移动 |
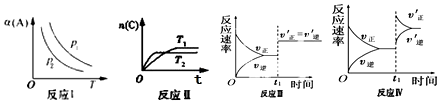
| A. | 反应 I:若 p1>p2,则 a+b<c | |
| B. | 反应Ⅱ:此反应的△H<0,且 T1<T2 | |
| C. | 反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响 | |
| D. | 反应Ⅳ:表示t1时刻增大 B 的浓度对反应速率的影响 |
| A. | Al3+、K+、NO3-、Cl- | B. | K+、Na+、HCO3-、Cl- | ||
| C. | Na+、CO32-、SO42-、NO3- | D. | Ba2+、Na+、Cl-、NO3- |
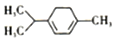
| A. | 该物质属于芳香族化合物,难溶于水 | |
| B. | 该物质可以发生消去、氧化、取代等反应 | |
| C. | 该分子结构中所有碳原子可能共平面 | |
| D. | 该有机物的一氯取代物有7种(不含立体结构) |
| A. | 6种 | B. | 7种 | C. | 8种 | D. | 9种 |
| A. | 海水淡化的常用方法有蒸馏法、离子交换法和电解法 | |
| B. | 钢铁在焊接前可以用NH4C1溶液的酸性清除表面的铁锈 | |
| C. | 甲醛和苯酚通过加聚反应制得酚醛树脂 | |
| D. | 在轮船外壳上焊接锌块或接直流电源正极,均可减缓船体的腐蚀速率 |