题目内容
1.工业上常用氨气为原料制备硝酸,其中有一步非常重要的反应为:4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O该反应的氧化剂为O2,还原剂为NH3.用单线桥法表示该氧化还原反应电子转移的方向和数目: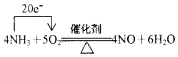 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
分析 反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O中,N元素化合价由-3价升高到+2价,则NH3为还原剂,O元素化合价由0价降低到-2价,则O2为氧化剂,转移电子数为20e-,据此分析解答.
解答 解:(反应4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O中,N元素化合价由-3价升高到+2价,则NH3为还原剂,O元素化合价由0价降低到-2价,则O2为氧化剂,转移电子数为20e-,用单线桥法表示该氧化还原反应电子转移的方向和数目为: ;若有标准状况下V L氨气完全反应,并转移n个电子,则$\frac{n}{N{\;}_{A}}$=$\frac{V}{22.4}$×5,所以阿伏加德罗常数(NA)可表示为:$\frac{22.4n}{5V}$,
;若有标准状况下V L氨气完全反应,并转移n个电子,则$\frac{n}{N{\;}_{A}}$=$\frac{V}{22.4}$×5,所以阿伏加德罗常数(NA)可表示为:$\frac{22.4n}{5V}$,
故答案为:O2;NH3; ;$\frac{22.4n}{5V}$.
;$\frac{22.4n}{5V}$.
点评 本题考查氧化还原反应的基本概念,侧重于学生的分析能力的考查,为高考常见题型,把握反应中元素的化合价变化为解答的关键,题目难度不大.

练习册系列答案
相关题目
11.下列关于金属Na的叙述中,说法不正确的是( )
| A. | Na在空气中燃烧,发出黄色火焰 | B. | Na在空气中燃烧,产物是Na2O | ||
| C. | Na是银白色金属,硬度小,熔点低 | D. | Na、K合金可作原子反应堆的导热剂 |
12.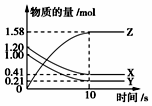 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.079mol•(L•s)-1 | |
| B. | 反应开始到10 s,X的物质的量浓度减少了0.79mol•L-1 | |
| C. | 该反应不是可逆反应 | |
| D. | 反应的化学方程式为X(g)+Y(g)?Z(g) |
6.在一密闭容器中充入1mol H2和1mol I2,压强为p(Pa),在一定温度下反应:H2(g)+I2(g)?2HI(g)△H<0,平衡后改变条件,下列叙述正确的是( )
| A. | 保持容器容积不变,向其中加入1 mol N2(N2不参加反应),反应速率加快 | |
| B. | 提高起始的反应温度,正反应速率加快,逆反应速率减慢,平衡正向移动 | |
| C. | 保持容器内气体压强不变,向其中加入1 mol Ne,反应速率加快,平衡正向移动 | |
| D. | 保持容器内气体压强不变,向其中加入1 mol H2(g)和1 mol I2(g),反应速率不变 |
13.表实验中,所采取的分离或提纯方法与对应原理都正确的是( )
| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |

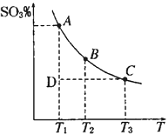 硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题:
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)?2SO3(g),混合体系中SO3的百分含量和温度的关系如图所示(曲线上任何一点都表示平衡状态).根据图示回答下列问题: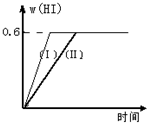 Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
Ⅱ将1mol I2(g)和2mol H2置于2L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)?2HI(g);△H<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示: