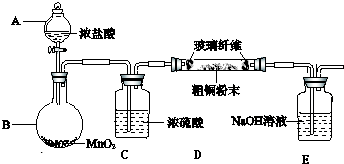
题目内容
16.2015年初,雾霾天气多次肆虐我国中东部地区,其中汽车尾气是造成空气污染的主要原因,汽车尾气净化的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ 2CO2(g)+N2(g).在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图1所示.
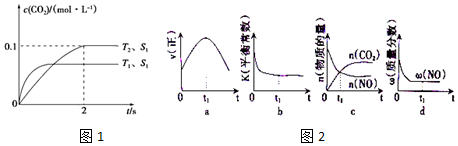
(1)该反应的△H<0(选填“>”、“<”).
(2)在T2温度下,0~2s内的平均反应速率v(N2)=0.025mol/(L•s).
(3)当固体催化剂的质量一定时,增大其表面即可提高化学反应速率,若催化剂的表面积S1>S2,在图1中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线.
(4)若该反应在绝热、恒容的密闭体系中进行,图2的示意图正确且能说明反应在t1时刻处于化学平衡状态的是bd(填代号).
分析 (1)根据“先拐先平数值大”知,T1>T2,升高温度二氧化碳含量降低,说明平衡逆向移动,升高温度平衡向吸热方向移动;
(2)在T2温度下,0~2s内,△c(CO2)=(0.1-0)mol/L=0.1mol/L,根据方程式知,△c(N2)=$\frac{1}{2}$△c(CO2),v(N2)=$\frac{△c}{△t}$;
(3)催化剂接触面积越大反应速率越快,能缩短反应达到平衡的时间,但二氧化碳转化率不变.
(4)当反应前后改变的物理量不变时可逆反应达到平衡状态.
解答 解:(1)根据“先拐先平数值大”知,T1>T2,升高温度二氧化碳含量降低,说明平衡逆向移动,升高温度平衡向吸热方向移动,所以正反应是放热反应,△H<0,故答案为:<;
(2)在T2温度下,0~2s内,△c(CO2)=(0.1-0)mol/L=0.1mol/L,根据方程式知,△c(N2)=$\frac{1}{2}$△c(CO2),v(N2)=$\frac{△c}{△t}$=$\frac{\frac{1}{2}×0.1mol/L}{2s}$=0.025mol/(L•s),
故答案为:0.025mol/(L•s);
(3)催化剂接触面积越大反应速率越快,能缩短反应达到平衡的时间,但二氧化碳转化率不变,所以其图象为 ,故答案为:
,故答案为: .
.
(4)a、到达平衡后正、逆速率相等,不再变化,t1时刻V正最大,之后随反应进行速率发生变化,未到达平衡,故a错误;
b、该反应正反应为放热反应,随反应进行温度升高,化学平衡常数减小,到达平衡后,温度为定值,达最高,平衡常数不变,为最小,图象与实际符合,故b正确;
c、t1时刻后二氧化碳、NO的物质的量发生变化,t1时刻未到达平衡状态,故c错误;
d、NO的质量分数为定值,t1时刻处于平衡状态,故d正确,
故答案为:bd.
点评 本题考查图象分析及化学平衡常数的判断,为高频考点,明确外界条件对化学反应速率、化学平衡影响原理是解本题关键,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,易错点是(4)a,题目难度不大.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案| A. | 20 mol、25% | B. | 20 mol、75% | C. | 40 mol、30% | D. | 10mol、50% |
| A. | 用蘸浓盐酸的玻璃棒靠近盛放氨气的装置,检查是否漏气 | |
| B. | 浓硫酸沾在皮肤上,立刻用稀氢氧化钠溶液冲洗 | |
| C. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| D. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 |
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
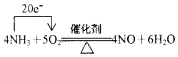 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
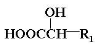 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为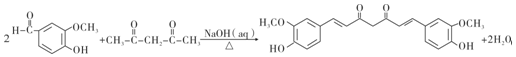
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.