题目内容
13.表实验中,所采取的分离或提纯方法与对应原理都正确的是( )| 选项 | 目 的 | 分离方法 | 原 理 |
| A | 分离溶于水中的碘 | 乙醇萃取 | 碘在乙醇中的溶解度较大 |
| B | 分离乙酸乙酯和乙醇 | 分液 | 乙酸乙酯和乙醇的密度不同 |
| C | 除去乙烷中混有的乙烯 | 酸性高锰酸钾溶液洗气 | 乙烯与酸性高锰酸钾溶液反应而乙烷不能 |
| D | 除去乙酸乙酯中混有的乙酸 | 用饱和碳酸钠溶液洗涤后分液 | 乙酸能与碳酸钠反应生成溶于水的盐 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.乙醇和水混溶,不能用作萃取剂;
B.乙酸乙酯和乙醇混溶,不能用分液的方法分离;
C.乙烯被氧化生成二氧化碳,引入新杂质;
D.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应.
解答 解:A.乙醇和水混溶,不能用作萃取剂,应用四氯化碳或苯萃取,故A错误;
B.乙酸乙酯和乙醇混溶,不能用分液的方法分离,应用蒸馏的方法分离,故B错误;
C.乙烯被氧化生成二氧化碳,引入新杂质,应用溴水除杂,故C错误;
D.乙酸乙酯不溶于饱和碳酸钠溶液,乙酸与碳酸钠反应,可用于分离,故D正确.
故选D.
点评 本题考查物质的分离提纯的实验方案的设计,为高频考点,题目难度不大,注意相关物质的性质的异同,把握常见物质的分离方法和操作原理.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
4.将一定量Fe和Fe2O3的混合物放入300mL 2mol/L的硝酸溶液中,反应完全后无固体剩余,生成4.48L NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )
| A. | 400mL | B. | 500mL | C. | 450mL | D. | 无法确定 |
8.同种类型的物质往往具有某些相同的性质.下列性质中不属于酸的通性的是( )
| A. | 与碱反应生成盐和水 | B. | 使紫色石蕊试液变蓝色 | ||
| C. | 与活泼金属反应生成盐和氢气 | D. | 与氧化钠反应生成盐和水 |
3.室温时,向四份各1L 0.01mol•L-1的HCl溶液中分别加入0.02mol表中的金属,反应完成后再加入0.01mol的另一种金属,在全过程中,放出气体最多的是( )
| 选项 | A | B | C | D |
| 第一次加入 | Al | Na | Zn | Mg |
| 第二次加入 | K | Mg | Al | Cu |
| A. | A | B. | B | C. | C | D. | D |
7.下列说法正确的是( )
| A. | 在101 kPa时,1 mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热 | |
| B. | 酸和碱发生中和反应生成1 mol水,这时的反应热叫中和热 | |
| C. | 燃烧热和中和热是反应热的种类之一 | |
| D. | 在稀溶液中,1 mol乙酸和1 mol氢氧化钠完全中和时放出的热量为57.3 kJ |
8.已知:a.C2H2(g)+H2(g)=C2H4(g)△H<0 b.2CH4(g)=C2H4(g)+2H2(g)△H>0
判断以下3个热化学方程式:①C(s)+2H2(g)=CH4(g)△H1
②C(s)+$\frac{1}{2}$H2(g)=$\frac{1}{2}$C2H2(g)△H2③C(s)+H2(g)=$\frac{1}{2}$C2H4(g)△H3
△H1、△H2、△H3由大到小的顺序是( )
判断以下3个热化学方程式:①C(s)+2H2(g)=CH4(g)△H1
②C(s)+$\frac{1}{2}$H2(g)=$\frac{1}{2}$C2H2(g)△H2③C(s)+H2(g)=$\frac{1}{2}$C2H4(g)△H3
△H1、△H2、△H3由大到小的顺序是( )
| A. | △H2>△H3>△H1 | B. | △H3>△H2>△H1 | C. | △H3>△H1>△H2 | D. | △H1>△H2>△H3 |
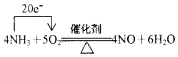 .若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
.若有标准状况下V L氨气完全反应,并转移n个电子,则阿伏加德罗常数(NA)可表示为$\frac{22.4n}{5V}$(写出含字母的表达式).
 ,该反应的反应类型为加成反应
,该反应的反应类型为加成反应 
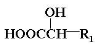 上的羟基可以氧化成羰基,再脱羧变成醛;
上的羟基可以氧化成羰基,再脱羧变成醛; (R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为
(R1、R2、R3和R4表示烃基或氢),且姜黄素具有称结构.由G制取姜黄素的化学方程式为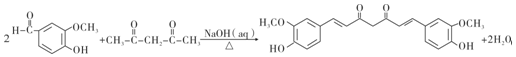
 可用于合成有机高分子色素,根据Claisen缩合反应,设计
可用于合成有机高分子色素,根据Claisen缩合反应,设计 .
.