题目内容
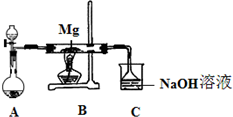 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.(1)选择制取SO2的合适试剂
①浓HCl ②浓H2SO4 ③Na2SO3固体 ④CaSO3固体
(2)上述装置还可优化,优化的方法是
(3)甲同学推测Mg与SO2的反应与CO2相似,则该反应方程式为
| ||
| ||
已知:MgSO3和MgS都是微溶于水,能与盐酸发生复分解反应放出气体;H2S气体通入CuSO4溶液中出现黑色沉淀.限选试剂:2mol/L HCl、2mol/L HNO3、蒸馏水、2mol/LNaOH、品红溶液、澄清石灰水、2mol/LCuSO4;仪器和用品自选.
| 序号 | 实验步骤 | 预期现象和结论 |
| ① | 取少量反应后所得固体于试管中 | |
| ② | 向试管中的固体慢慢滴加 试管口塞上带导管的单孔塞,并将导管通入盛有 |
若试管中的 则丙同学推测正确. 若试管中的固体未完全溶解,且 |
(4)上述实验需要100mL,2mol/L的HCl,配制时选用
考点:性质实验方案的设计
专题:实验设计题
分析:(1)根据实验室制备SO2的原理,强酸制弱酸;
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;根据 SO2有毒,会污染大气分析;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫;可根据反应产物的性质进行验证甲、乙、丙三位同学的推测是否正确;
(4)根据溶液稀释前后溶质的质量或物质的量不变解答;
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管;根据 SO2有毒,会污染大气分析;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫;可根据反应产物的性质进行验证甲、乙、丙三位同学的推测是否正确;
(4)根据溶液稀释前后溶质的质量或物质的量不变解答;
解答:
解:(1)因SO2的溶解度较大,应选用浓度较大的H2SO4溶液;为了使反应顺利进行须选择Na2SO3固体与硫酸反应(CaSO3固体与硫酸反应生成的硫酸钙微溶于水).
故选②③.
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管.装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境,故答案为:在A和B之间未连接一干燥装置;吸收多余的SO2,防止污染环境;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫,反应方程式为:2Mg+SO2
2MgO+S,欲验证甲、乙、丙三位同学的推测是否正确,可根据反应产物的性质进行检验,MgSO3、MgO、MgS均溶于盐酸,硫不溶于盐酸;MgSO3与盐酸反应生成二氧化硫能使品红溶液褪色;若甲同学推测正确,加过量2mol/L盐酸MgO溶于盐酸但不生成二氧化硫,硫不溶于盐酸,现象为固体未完全溶解且品红溶液不褪色;若乙同学的推测是正确的,加过量2mol/L盐酸后MgSO3溶于盐酸且生成二氧化硫,硫不溶于盐酸,现象为固体未完全溶解且品红溶液褪色;若丙同学的推测是正确的,加过量2mol/L盐酸MgO、MgS溶于盐酸但不生成二氧化硫,现象为固体完全溶解且品红溶液不褪色,故答案为:2Mg+SO2
2MgO+S;
向反应后所得固体加过量2mol/L盐酸,固体未完全溶解且品红溶液不褪色(或反应后固体未完全溶解于盐酸且无气体产生);
(4)设需浓盐酸的体积为x,
2mol/L×0.1L×36.5g/mol=1.19g/mL×x×36.5%,解得x=16.8mL,配制时应选用量筒的规格应稍大于16.8mL,故应选25mL的量筒,故答案为:25mL;16.8mL.
故选②③.
(2)硫酸和亚硫酸钠反应生成硫酸钠、二氧化硫和水,所以在二氧化硫气体中含有水蒸气,水蒸气影响镁的化学反应,所以应在A、B之间加一个干燥管.装置C中NaOH溶液的作用是吸收多余的SO2,防止污染环境,故答案为:在A和B之间未连接一干燥装置;吸收多余的SO2,防止污染环境;
(3)根据Mg与CO2的反应知:Mg与SO2反应能生成氧化镁与单质硫,反应方程式为:2Mg+SO2
| ||
| ||
| ② | 2mol/L 盐酸至过量; 品红 |
固体完全溶解; 品红溶液褪色; |
(4)设需浓盐酸的体积为x,
2mol/L×0.1L×36.5g/mol=1.19g/mL×x×36.5%,解得x=16.8mL,配制时应选用量筒的规格应稍大于16.8mL,故应选25mL的量筒,故答案为:25mL;16.8mL.
点评:本题以信息为载体,考查了学生分析问题的能力,难度较大,会从教材中找出问题原型,对信息进行迁移来解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列对电离平衡常数K的叙述中,不正确的是( )
| A、与溶液的物质的量浓度有关 |
| B、只与温度有关,而与浓度无关 |
| C、根据相同条件下K的大小,可以判断弱酸的相对强弱 |
| D、升高温度K增大 |
苯的同系物C12H18有多种同分异构体,其中二取代苯的同分异构体(不考虑立体异构)有( )
| A、48种 | B、45种 |
| C、42种 | D、以上都不是 |
 已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.
已知A、B、C、D、E都是元素周期表中前36号的元素,它们的原子序数依次增大.A原子基态时最外层电子数是其内层电子总数的2倍,B原子基态时s电子数与P电子数相等,C在元素周期表的各元素中电负性最大,D的基态原子核外有6个能级且全部充满电子,E原子基态时未成对电子数是同周期元素中最多的.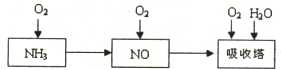 工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下:
