题目内容
钒有金属“维生素”之称,研究发现钒的某些化合物对治疗糖尿病有很好的疗效.
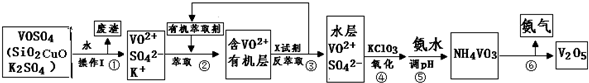
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:
请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):VOSO4(水层)+2HM(有机层)?VOM2(有机层)+H2SO4(水层)
步骤②中萃取时必须加入适量碱,其原因是 .步骤③中X试剂为 .
(2)步骤④的离子方程式为 .
(3)该工艺流程中,可以循环利用的物质有 和 .
(4)操作Ⅰ得到的废渣,用 溶解,充分反应后, ,(填写系列操作名称)称量得到mg氧化铜.
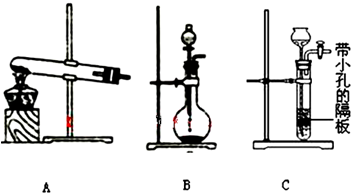
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.
工业上设计将VOSO4中的K2SO4、SiO2、CuO杂质除去并回收得到V2O5的流程如下:

请回答下列问题:
(1)步骤②、③的变化过程可表示为(HM为有机萃取剂):VOSO4(水层)+2HM(有机层)?VOM2(有机层)+H2SO4(水层)
步骤②中萃取时必须加入适量碱,其原因是
(2)步骤④的离子方程式为
(3)该工艺流程中,可以循环利用的物质有
(4)操作Ⅰ得到的废渣,用
(5)为了制得氨水,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中.

| 实验装置 | 实验药品 | 制备原理 | |
| 甲小组 | A | 氢氧化钙、氯化铵 | 反应的化学方程式为① |
| 乙小组 | ② |
浓氨水、氢氧化钠固体 | 分析产生氨气的原因③ |
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行;
(2)步骤④加入KClO3使VO2+氧化为VO3-,则本身被还原为Cl-,配平得离子方程式;
(3)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
(4)根据氧化铜和二氧化硅的性质的不同和物质分离的方法判断;
(5)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
(2)步骤④加入KClO3使VO2+氧化为VO3-,则本身被还原为Cl-,配平得离子方程式;
(3)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
(4)根据氧化铜和二氧化硅的性质的不同和物质分离的方法判断;
(5)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
解答:
解:(1)②中萃取时必须加入适量碱,分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会和平衡中的氢离子反应促进平衡正向进行;③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行,
故答案为:加入碱中和产生的酸,平衡右移提高了钒的萃取率;硫酸;
(2)步骤④加入KClO3使VO2+氧化为VO3-,则本身被还原为Cl-,配平得离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+,
故答案为:ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+;
(3)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂;氨气.
(4)操作Ⅰ得到的废渣的成分是氧化铜和二氧化硅,氧化铜为碱性氧化物与碱不反应,二氧化硅是酸性氧化物溶于氢氧化钠溶液,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜,故答案为:氢氧化钠溶液;过滤、洗涤、干燥;
(5)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2
2NH3↑+2H2O+CaCl2;
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:B;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
故答案为:加入碱中和产生的酸,平衡右移提高了钒的萃取率;硫酸;
(2)步骤④加入KClO3使VO2+氧化为VO3-,则本身被还原为Cl-,配平得离子方程式为ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+,
故答案为:ClO3-+6VO2++9H2O=Cl-+6VO3-+18H+;
(3)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,故答案为:有机萃取剂;氨气.
(4)操作Ⅰ得到的废渣的成分是氧化铜和二氧化硅,氧化铜为碱性氧化物与碱不反应,二氧化硅是酸性氧化物溶于氢氧化钠溶液,充分反应后,过滤、洗涤、干燥,称量得到mg氧化铜,故答案为:氢氧化钠溶液;过滤、洗涤、干燥;
(5)①氢氧化钙与氯化铵反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2
| ||
故答案为:2NH4Cl+Ca(OH)2
| ||
②浓氨水是液体,氢氧化钠是固体,为使氨气逸出,把氨水滴入固体氢氧化钠中,随着氢氧化钠溶解放热,温度升高,使氨的溶解度减小而放出,故选B装置;氢氧化钠溶于氨水后放热、增加氢氧根浓度,使NH3+H2O?NH3?H2O?NH4++OH-向逆方向移动,加快氨气逸出,
故答案为:B;氧氧化钠吸水,促使氨放出;氢氧化钠电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出.
点评:本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等

练习册系列答案
相关题目
已知化学式为C4H10O的醇有4种异构体,若在该分子中增加1个羰基,形成的C5H10O2的羧酸可能有的结构有( )
| A、2种 | B、4种 | C、6种 | D、5种 |
将4gNaOH固体溶于水配成50mL溶液,其物质的量浓度为( )
| A、0.1mol/L |
| B、2mol/L |
| C、1mol/L |
| D、0.5mol/L |
下列物质都能与金属钠反应放出H2,产生H2的速率排序正确的是( )
①C2H5OH ②NaOH溶液 ③醋酸溶液.
①C2H5OH ②NaOH溶液 ③醋酸溶液.
| A、③>②>① |
| B、②>①>③ |
| C、①>②>③ |
| D、③>①>② |
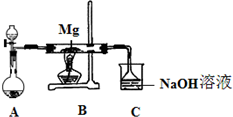 SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.
SiO2、SO2和CO2都是酸性氧化物,它们的化学性质具有一定的相似性;Mg和Na的化学性质也具有一定相似性.某兴趣小组用如图所示装置进行Mg与SO2反应的实验.