题目内容
11.1902年德国化学家哈伯研究出合成氨的方法.(1)某温度时,N2与H2反应(可逆反应)过程中的能量变化如图1所示.
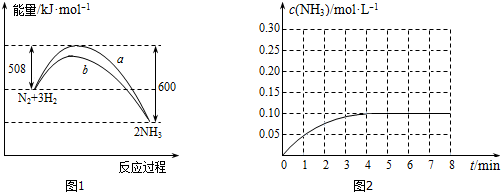
①写出合成氨的热化学方程式N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol.
②下列叙述正确的是abc.
A.b曲线是加入催化剂时的能量变化曲线
B.在密闭容器中加入28gN2、6gH2,充分反应放出的热量小于92kJ
C.由图可知,断开1molN≡N键与3molH-H键吸收的能量和小于形成6molN-氮氢键所放出的能量
D.反应物的总能量低于生成物的能量
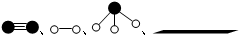
(2)在一容积为4L的密闭容器中,加入0.4molN2和1.2molH2,在一定条件下发生反应,反应中NH3的物质的量浓度变化情况如图2所示.据图计算从反应开始到平衡时,平均反应速率?(H2)为0.0375mol/(L•min),平衡时,c(N2)为0.05mol/L.
(3)哈伯因证实N2、H2在固体催化剂(Fe)表面吸附和解吸以合成氨的过程而获诺贝尔奖.若用
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).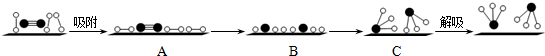
分析 (1)①△H=放出的能量-吸收的能量;
②合成氨的反应为可逆反应,不能进行彻底,且为放热反应,使用催化剂能降低正逆反应的活化能,据此分析;
(2)根据v(H2)=$\frac{3}{2}$c(NH3)进行计算;
(3)化学键的断裂要吸收能量,且该反应放热.
解答 解:(1)①△H=放出的能量-吸收的能量=508KJ/mol-600KJ/mol=-92KJ/mol,故热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92KJ/mol;
②A.使用催化剂能降低正逆反应的活化能,但不能改变反应的热效应,故b曲线是加入催化剂时的能量变化曲线,故a正确;
B.由于合成氨的反应为可逆反应,不能进行彻底,故在密闭容器中加入28gN2、6gH2,充分反应放出的热量小于92kJ,故b正确;
C.由图可知,断开1molN≡N键与3molH-H键吸收的能量和为508KJ,小于形成6molN-氮氢键所放出的能量600KJ,故c正确;
D.由图可知,反应物的总能量高于生成物的能量,反应放热,故d错误.
故选abc;
(2)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min);平衡时氨气的浓度为0.1mol/L,即△c(NH3)=0.1mol/L,而浓度的该变量之比等于计量数之比,故△c(N2)=0.05mol/L,而氮气的初始浓度为0.1mol/L,故平衡时,c(N2)为0.05mol/L.
故答案为:0.0375;0.05mol/L;
(3)由于化学键的断裂要吸收能量,故活化状态B的能量高于初始状态A的能量,而此反应为放热反应,故初始状态A的能量高于末态C的能量,故B的能量最低高,
故答案为:B.
点评 本题考查热化学方程式的书写、化学反应速率的计算等知识点,为高频考点,明确化学反应原理是解本题关键,侧重考查学生分析计算能力,难点是反应速率,题目难度中等.

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案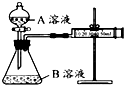 某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:
某实验小组利用 KMnO4 酸性溶液与弱酸 H2C2O4溶液反应进行“外界因素对反应速率 影响”的探究,设计实验方案如下:甲组:通过测定生成 CO2气体体积的方法来比较化学反应速率的大小.实验装置如图,实验时分 液漏斗中A溶液一次性放入B溶液中.
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L-1 H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
| ② | 2mL 0.1mol/L -1H2C2O4溶液 | 4mL 0.01mol/L-1 KMnO4溶液 |
(1)写出锥形瓶中加入A溶液后发生反应的离子方程式:2MnO4-+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O.
(2)该组的实验目的是探究H2C2O4溶液浓度对化学反应速率的影响. 分析所给实验仪器,实现该实验目的还欠缺的仪器:秒表.
乙组:通过测定溶液褪色时间来判断反应速率快慢,实验记录如下表(各实验均在室温下进行):
| 实验 编号 | 温度/℃ | 烧杯中所加的试剂及其用量 (mL) | 加入 少量固体 | 溶液褪色 时间(s) | |||
| 0.6mol•L-1 H2C2O4溶液 | H O | 0.2mol•L-1 KMnO4溶液 | 3mol•L-1 稀硫酸 | ||||
| ① | 25 | 30.0 | 20.0 | 30.0 | 20.0 | 无 | 1.8 |
| ② | 50 | V1 | V2 | 30.0 | 20.0 | 无 | 1.0 |
| ③ | 25 | 15.0 | V3 | 15.0 | 10.0 | 无 | 3.6 |
| ④ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | K2SO4 | 1.8 |
| ⑤ | 25 | 30.0 | 20.0 | 30.0 | 20.0 | MnSO4 | 0.6 |
(4)根据乙组的实验记录,下列结论正确的是C A.实验③中,V3=10
B.实验①③说明反应速率只与 KMnO4 浓度有关
C.根据实验①⑤可推出实验①中的反应速率变化是:起初较小,后明显变大,又逐渐变小.
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)③的最低价气态氢化物分子中的化学键类型为极性键(填“极性键”或“非极性键”),该分子的空间构型为为V形,③的最低价气态氢化物比⑧的最低价气态氢化物沸点高(填“高”或“低”),原因是H2O分子之间含氢键
(5)元素的非金属性:①> ⑦(填“>”或“<”).
(6)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);碱性最强的是NaOH(填化学式),它与⑨的最高价氧化物的水化物反应的化学方程式为NaOH+HClO4=NaClO4+H2O.
| A. | 冰 | B. | 过氧化钠 | C. | 氯化钠 | D. | 白磷 |
| A. | C-O键的极性比N-O键的极性大 | |
| B. | CO和N2互为等电子体,且N2的沸点比CO的高 | |
| C. | H2CO3、H2SiO3、H3PO4酸性越来越弱 | |
| D. | 金属K采用面心立方堆积,空间利用率为74% |
| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
| A. | 浓硝酸的氧化性强于稀硝酸 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| D. | 原子半径:Al>Si>P |
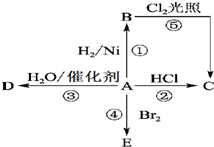 某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题:
某气态烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A也是一种植物生长调节剂,A可发生如图所示的一系列化学反应.根据该图回答下列问题: