题目内容
6.共价键、离子键和分子间作用力是物质间的不同作用力,下述物质中只含上述一种作用力的是( )| A. | 冰 | B. | 过氧化钠 | C. | 氯化钠 | D. | 白磷 |
分析 一般金属元素与非金属元素之间形成离子键,非金属元素之间形成共价键,分子之间存在分子间作用力,以此来解答.
解答 解:A.干冰为固态二氧化碳,存在共价键和分子间作用力,故A不选;
B.过氧化钠中存在离子键和共价键,故B不选;
C.氯化钠中只有离子键,故C选;
D.白磷单质中存在分子间作用力和共价键,故D不选;
故选C.
点评 本题考查化学键,熟悉常见物质中的化学键及化学键的形成规律即可解答,注意分子晶体中存在分子间作用力,不属于化学键.

练习册系列答案
相关题目
17.下面四个选项是四位同学在学习化学反应速率和化学平衡理论以后,联系化工生产实际所发表的看法,你认为不正确的是( )
| A. | 化学反应速率理论可指导怎样在一定时间内快出产品 | |
| B. | 化学平衡理论可指导怎样使用有限原料多出产品 | |
| C. | 当反应达到限度时,无论外界条件如何变化,反应体系内各物质含量始终不变 | |
| D. | 正确利用化学反应速率和化学平衡理论都可提高化工生产的综合经济效益 |
14.表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=1.0×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=6,则V1:V2=1:1.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)=2c(SO42-)>c(H+)=c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=1.0×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=6,则V1:V2=1:1.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)=2c(SO42-)>c(H+)=c(OH-).
18.有反应mA(g)+nB(g)?wC(g),测得在同一时间内A每分钟减少0.15mol•L-1,B每分钟减少0.05mol•L-1,C每分钟增加0.1mol•L-1,则下列叙述不正确的是( )
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
15.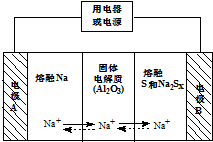 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
(1)根据表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
16. 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
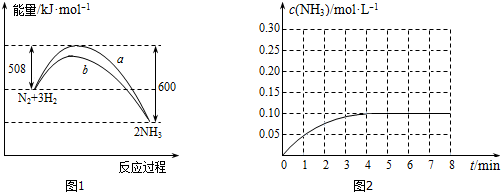
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol•L-1的溶液中逐滴滴加稀氨水,产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2(用化学式表示).
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
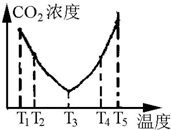
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
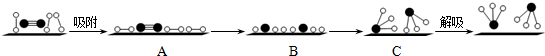
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).