题目内容
20.电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O 和Zn,电解质为KOH溶液,电极总反应为:Ag2O+H2O+Zn=Zn(OH)2+2Ag.下列叙述不正确的是( )| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
分析 根据电池反应式知,锌失电子发生氧化反应而作负极,电极反应式为Zn-2e-+2OH-═Zn(OH)2,氧化银得电子发生还原反应而作正极,电极反应式为Ag2O+2e-+H2O═2Ag+2OH-,结合电子的移动方向分析解答.
解答 解:A.根据电池反应式知,锌失电子化合价升高而作负极,电极反应式为Zn-2e-+2OH-═Zn(OH)2,所以消耗了锌,锌的质量会减少,故A正确;
B.根据电池反应式知,锌失电子化合价升高而作负极,氧化银作正极,故B正确;
C.电池工作时电子从负极出来沿外电路流向正极,由于锌作负极,氧化银作正极,所以电子是由Zn流向Ag2O,溶液中无电子,是离子作定向移动,故C错误;
D.溶液中的离子作定向移动,是阴离子移向负极,阳离子称向正极,所以溶液中氢氧根离子向负极Zn移动,故D正确;
故选C.
点评 本题考查了化学电源新型电池,根据电池反应式中元素化合价变化来确定正负极,再结合离子移动方向来分析解答,难度不大.

练习册系列答案
相关题目
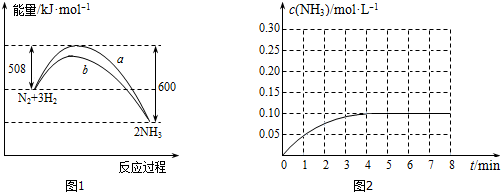
10.将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3下列关于该反应的说法中正确的是( )
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
8.在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
15.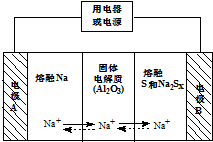 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
(1)根据表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
5.下列有机物名称正确的是( )
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
12.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技 材料,被誉为“未来金属”.以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1
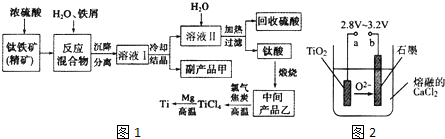
请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于10时,Mg(OH)2开始沉淀.若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O=TiO(OH)2↓.
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.

请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.
10.化学与生活息息相关,下列说法正确的是( )
| A. | 我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | 长期烧水的水壶内壁容易形成一层水垢,可以用食醋除去 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
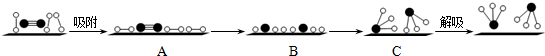
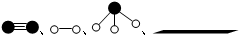 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).