题目内容
3.下列叙述正确的是( )| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
分析 在原子的构成中,元素符号左上角的数字表示原子的质量数;原子中,质量数=质子数+中子数,核内质子数=核外电子数=原子序数;元素符号的左上角为质量数.
解答 解:A.1H和 2H的质子数都为1,中子数分别为0、1,所以1H和 2H是不同的核素,故A错误;
B.6Li和 7Li的质子数都为3,电子数也都为3,中子是分别为6-3=3、7-3=4,所以中子数不相等,故B正确;
C.14C和 14N的质量数相等,质子数分别为6、7,中子数分别为14-6=8、14-7=7,所以它们的中子数不等,故C错误;
D.13C和 14C的质量数分别为13、14,故D错误;
故选B.
点评 本题考查同位素及原子的构成,明确同位素的概念及原子中的量的关系是解答本题的关键,难度不大,注重了对基础知识的考查.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目
14.表是不同温度下水的离子积数据:
试回答下列问题:
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=1.0×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=6,则V1:V2=1:1.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)=2c(SO42-)>c(H+)=c(OH-).
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
①若25<t1<t2,则α>1×10-14(填“>”“<”或“=”)
②25℃下,某Na2SO4溶液中c(SO42-)=1.0×10-4 mol•L-1,取该溶液1mL,加水稀释至10mL,则稀释后溶液中c (Na+):c (OH-)=1000:1
③t2℃下,将pH=11的苛性钠溶液V1 L与pH=1的稀硫酸V2 L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=6,则V1:V2=1:1.此溶液中各种离子的浓度由大到小的排列顺序是c(Na+)=2c(SO42-)>c(H+)=c(OH-).
18.有反应mA(g)+nB(g)?wC(g),测得在同一时间内A每分钟减少0.15mol•L-1,B每分钟减少0.05mol•L-1,C每分钟增加0.1mol•L-1,则下列叙述不正确的是( )
| A. | m:n:w=3:1:2 | |
| B. | 体积和温度不变时,若在前10s内A减少了x mol,则B在前20s内减少$\frac{2x}{3}$ mol | |
| C. | 体积和温度不变时,随反应进行压强逐渐下降,一段时间后压强保持恒定不变 | |
| D. | 单位时间内反应物浓度的减少大于生成物浓度的增加 |
8.在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
15.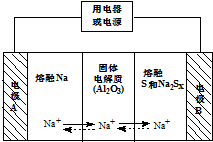 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
(1)根据表数据,判断该电池工作的适宜温度应为C(填字母序号).
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
12.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
13.氯化硫(S2Cl2)的结构式为Cl-S-S-Cl,常温下为浅黄色油状液体,遇与水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓.下列有关此反应的说法正确的是( )
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |

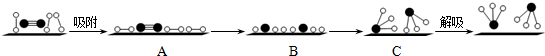
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).