题目内容
1.下列说法不能用元素周期律解释的是( )| A. | 浓硝酸的氧化性强于稀硝酸 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| D. | 原子半径:Al>Si>P |
分析 A.硝酸的浓度越大,氧化性越强;
B.金属性越强,与冷水反应速率越快;
C.Br2+2I-=I2+2Br-,体现了Br的非金属性大于I;
D.同周期随着原子序数的增加,原子半径逐渐减小.
解答 解:A.硝酸的浓度越大,氧化性越强,与元素周期律无关,故A错误;
B.与冷水反应的速率:Na>Mg,体现了金属性越强,与冷水反应速率越快,故B正确;
C.向淀粉KI溶液中滴入溴水,溶液变蓝,发生Br2+2I-=I2+2Br-,体现了Br的非金属性大于I,故C正确;
D.原子半径:Al>Si>P,体现了同周期随着原子序数的增加,原子半径逐渐减小的规律,故D正确;
故选A.
点评 本题考查了元素周期律,为高频考点,难度不大,明确元素周期律的内容是解题的关键.

练习册系列答案
 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案
相关题目
12.化学与社会、生产、生活密切相关.下列说法正确的是( )
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技 材料,被誉为“未来金属”.以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1
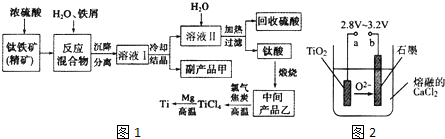
请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于10时,Mg(OH)2开始沉淀.若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O=TiO(OH)2↓.
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.

请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.
16. 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol•L-1的溶液中逐滴滴加稀氨水,产生沉淀的先后顺序为Fe(OH)3、Cu(OH)2、Fe(OH)2、Mg(OH)2(用化学式表示).
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
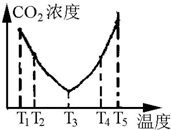
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
 氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.
氮的化合物在农业、国防工业、航天工业等领域有广泛的用途.(1)航天工业中常用N2H4做高能燃料,N2O4作氧化剂.已知N2(g)+O2(g)=2NO(g)△H=+180.7kJ•mol-1
2NO(g)+O2(g)=2NO2(g)△H=-113.0kJ•mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534.0kJ•mol-1
2NO2(g)?N2O4(g)△H=-52.7kJ•mol-1
N2H4(g)和N2O4(g)反应生成一种气态的10e-分子,还有一种极稳定的单质,写出反应的热化学方程式:2N2H4(g)+N2O4(g)?3N2(g)+4H2O(g)△H=-1083.0kJ•mol-1
(2)工业合成氨对人类社会的发展意义重大,在实验室中常用N2和H2在一定条件下进行合成氨的相关研究.T℃时,向容积为3L的密闭容器中,投入4mol N2和9mol H2,10min达到化学平衡状态,平衡时NH3的物质的量为2mol,则0~10min内H2的平均速率v(H2)=0.1mol/(L.min),平衡时N2的转化率α(N2)=25%.若再增加氢气浓度,该反应的平衡常数将不变(填“增大”、“减小”或“不变”).
(3)氨水是一种常用的沉淀剂和中和剂.
①已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 |
| Ksp | 2.2×10-20 | 4.0×10-38 | 8.0×10-16 | 1.8×10-11 |
②25℃时,将amol/L的氨水与b mol/L盐酸等体积混合,反应后溶液恰好显中性,则a>b. (填“>”、“<”或“=”);用a、b表示NH3•H2O的电离平衡常数Kb=$\frac{b×1{0}^{-7}}{a-b}$.
(4)(NH4)2CO3是一种捕碳剂,其捕捉CO2的原理为:
(NH4)2CO3(aq)+H2O(l)+CO2(g) 2NH4HCO3 (aq)△H
为研究温度对捕碳效率的影响,在不同温度条件下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2,在t时刻,测得容器中CO2气体的浓度.其关系如图:
①捕捉CO2反应的△H<0(填“>”、“=”或“<”).
②在T4~T5这个温度区间,容器内CO2气体浓度变化趋势的原因是:T4~T5反应达平衡,正反应为放热反应,随着温度的升高,平衡逆向移动,CO2的吸收效率降低(或NH4HCO3部分分解).
6.根据下列物质变化,所得能量变化关系正确的是( )
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 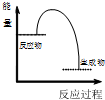 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
13.氯化硫(S2Cl2)的结构式为Cl-S-S-Cl,常温下为浅黄色油状液体,遇与水即分解:2S2Cl2+2H2O→4HCl+SO2↑+3S↓.下列有关此反应的说法正确的是( )
| A. | S2Cl2做氧化剂,H2O做还原剂 | |
| B. | 每生成l mol SO2转移4 mol电子 | |
| C. | 氧化产物与还原产物的物质的量之比为l:3 | |
| D. | 每生成48g硫会断裂2mol氢氧键 |
10.化学与生活息息相关,下列说法正确的是( )
| A. | 我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 | |
| B. | 人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 | |
| C. | 长期烧水的水壶内壁容易形成一层水垢,可以用食醋除去 | |
| D. | 明矾净水时发生了化学及物理变化,能起到杀菌、消毒的作用 |
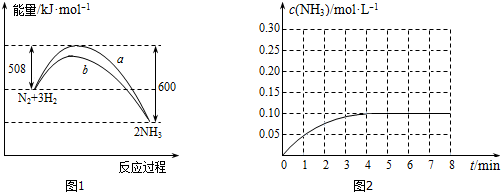
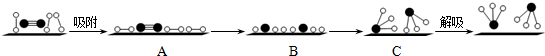
 分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).
分别表示N2、H2、NH3和固体催化剂,则在固体催化剂表面合成氨的过程可用如图表示.吸附后,能量状态最高的是B (填字母序号).