题目内容
已知A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增.①元素Y在A、B、C、D、E中所呈化合价依次递增,其中只有B为单质.②常温下将气体D通入水中发生反应,生成C和E;③工业上以A、空气和水为原料,通过催化氧化法制取E.请回答以下问题:
(1)B分子中含有的化学键为 ;A的分子式为 ;
(2)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式 .
(1)B分子中含有的化学键为
(2)由B反应生成1molA放出的热量为46.2kJ,写出该反应的热化学方程式
考点:位置结构性质的相互关系应用,热化学方程式
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E为中学化学常见的五种物质,均含元素Y,且Y在这些物质中所呈化合价依次升高,说明Y有多种化合价,可能为N元素或Cl元素,又工业上以A、空气和水为原料,通过催化氧化法制取E,应为氨的催化氧化制备硝酸,则A为NH3、B为N2、C为NO、D为NO2、E为HNO3,据此解答各小题即可.
解答:
解:依据分析可知:A为NH3、B为N2、C为NO、D为NO2、E为HNO3,
(1)由以上分析可知B为N2,由同种元素组成的共价键,为非极性共价键,A为氨气,分子式为:NH3,故答案为:非极性共价键;NH3;
(2)由B(N2)反应生成1molA(NH3)放出的热量为46.2kJ,则有N2(g)+2H2(g)
2NH3(g)△H=-92.4kJ/mol,故答案为:N2(g)+2H2(g)
2NH3(g)△H=-92.4kJ/mol.
(1)由以上分析可知B为N2,由同种元素组成的共价键,为非极性共价键,A为氨气,分子式为:NH3,故答案为:非极性共价键;NH3;
(2)由B(N2)反应生成1molA(NH3)放出的热量为46.2kJ,则有N2(g)+2H2(g)
| 催化剂 |
| 高温、高压 |
| 催化剂 |
| 高温、高压 |
点评:本题考查物质的推断,题目难度不大,本题侧重于化合价的角度,注意常见多化合价元素以及常见物质的性质.

练习册系列答案
 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l) △H=-57.3KJ?mol-1
分别向1L 0.5mol?L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀醋酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
分别向1L 0.5mol?L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀醋酸;③稀盐酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
| A、△H1>△H3>△H2 |
| B、△H1<△H3<△H2 |
| C、△H1>△H2=△H3 |
| D、△H1=△H2<△H3 |




 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.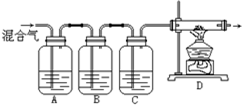 某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.
某学生设计一套实验装置如图所示,通过实验除去混在氮气中的氧气、二氧化碳、硫化氢和乙烯等气体,制得干燥的氮气.