题目内容
 水是组成生命体的重要化学物质,有关水的反应有很多.
水是组成生命体的重要化学物质,有关水的反应有很多.(1)水分子的空间构型为
(2)如图是某品牌饮用矿泉水标签的部分内容.请计算一瓶合格的这种矿泉水中硫酸根商子的物质的量不能超过
(3)标况下将a L氨气溶于1L水中,得到的溶液密度为bg.cm-3.用化学方程式表示氨气溶于水显碱性的原因
(4)已知M是生活中常见的一种金属,将44.8g M完全溶于很稀的过量硝酸,向所得溶液中加入
足量固体烧碱并加热,放出6.72L(标准状况)气体.M溶子该很稀的硝酸的离子方程式
为
(5)味精是常用的调味品,当前味精生产主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖.
①淀粉发生水解反应的化学方程式是
②实验室中检验淀粉水解产物应选用的试剂可以是
a.NaOH溶液、氨水、AgNO3溶液
b.H2SO4溶液、氨水、AgNO3溶液
c.NaOH溶液、CuSO4溶液
d.H2SO4溶液,CuSO4溶液.
考点:判断简单分子或离子的构型,电子式,物质的量浓度的相关计算,热化学方程式,物质的检验和鉴别的基本方法选择及应用
专题:
分析:(1)两个水分子自身作用会生成阴、阳两种离子,阳离子为H3O+;
(2)酸根离子的浓度最大为19.2mg/L,根据物质的量浓度公式计算物质的量;
(3)氨电离产生氢氧根离子,使溶液呈碱性,根据物质的量浓度公式计算物质的量浓度;
(4)设M的相对原子质量为m,化合价为+x价,在氧化还原反应中,硝酸被还原为铵根离子,根据氧化还原反应中电子得失守恒可知,产生6.72L氨气,共转移的电子的物质量为
×8mol=2.4mol,此时用去的M为44.8g,所以有
×x=2.4,即m=
x,M是生活中常见的一种金属,则可知M为铁,据此答题;
(5)①淀粉发生水解生成葡萄糖,据此写化学方程式;
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,再通过检验葡萄糖中的醛基证明产物,据此答题;
(2)酸根离子的浓度最大为19.2mg/L,根据物质的量浓度公式计算物质的量;
(3)氨电离产生氢氧根离子,使溶液呈碱性,根据物质的量浓度公式计算物质的量浓度;
(4)设M的相对原子质量为m,化合价为+x价,在氧化还原反应中,硝酸被还原为铵根离子,根据氧化还原反应中电子得失守恒可知,产生6.72L氨气,共转移的电子的物质量为
| 6.72 |
| 22.4 |
| 44.8 |
| m |
| 56 |
| 3 |
(5)①淀粉发生水解生成葡萄糖,据此写化学方程式;
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,再通过检验葡萄糖中的醛基证明产物,据此答题;
解答:
解:(1)因为水分子中氧原子有两对孤电子对,两个H-O键,所以分子构型为V形,两个水分子自身作用会生成阴、阳两种离子,阴离子为OH-,其电子式为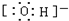 ,
,
故答案为:V形;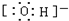 ;
;
(2)酸根离子的浓度最大为19.2mg/L,则500mL时硫酸根离子为0.5L×19.2mg/L=9.6mg,其物质的量为
=1×10-4mol,
故答案为:1×10-4;
(3)氨电离产生氢氧根离子,使溶液呈碱性,化学方程式为NH3?H2O?NH4++OH-,
NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质;
水的体积为1L,则水的质量=1L×1000g/mL=1000g,
氨气的物质的量为=
=
mol,
氨气的质量为
g,
溶液的质量为1000g+
g,
溶液的体积为=
L=
L,
氨水的物质的量浓度为c=
=
mol/L,
故答案为:NH3?H2O?NH4++OH-;
;
(4)设M的相对原子质量为m,化合价为+x价,在氧化还原反应中,硝酸被还原为铵根离子,根据氧化还原反应中电子得失守恒可知,产生6.72L氨气,共转移的电子的物质量为
×8mol=2.4mol,此时用去的M为44.8g,所以有
×x=2.4,即m=
x,M是生活中常见的一种金属,则可知M为铁,铁溶于该很稀的硝酸的离子方程式为 8Fe+30H++3NO3-═8Fe3++3NH4++9H2O,铁与水在高温条件下,生成lg气体即氢气,吸热akJ,则生成4mol氢气吸收8aKJ的热,所以该反应的热化学方程式为4H2O(g)+3Fe(s)=Fe3O4(s)+4H2(g)△H=8aKJ/mol,
故答案为:8Fe+30H++3NO3-═8Fe3++3NH4++9H2O;4H2O(g)+3Fe(s)=Fe3O4(s)+4H2(g)△H=8aKJ/mol;
(5)①淀粉发生水解生成葡萄糖,化学方程式为:(C6H10O5)n+nH2O
nC6H12O6,
故答案为:(C6H10O5)n+nH2O
nC6H12O6 ;
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,需要加氢氧化钠溶液,再通过检验葡萄糖中的醛基证明产物,需要加银氨溶液或新制氢氧化铜悬浊液,故选ac;
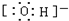 ,
,故答案为:V形;
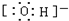 ;
;(2)酸根离子的浓度最大为19.2mg/L,则500mL时硫酸根离子为0.5L×19.2mg/L=9.6mg,其物质的量为
| 9.6×10-3g |
| 96g/mol |
故答案为:1×10-4;
(3)氨电离产生氢氧根离子,使溶液呈碱性,化学方程式为NH3?H2O?NH4++OH-,
NH3溶于水后虽然大部分生成NH3?H2O,但在计算时,仍以NH3作为氨水中的溶质;
水的体积为1L,则水的质量=1L×1000g/mL=1000g,
氨气的物质的量为=
| aL |
| 22.4L/mol |
| a |
| 22.4 |
氨气的质量为
| 17a |
| 22.4 |
溶液的质量为1000g+
| 17a |
| 22.4 |
溶液的体积为=
1000+
| ||
| 1000b |
| 22400+17a |
| 22400b |
氨水的物质的量浓度为c=
| ||
|
| 1000ab |
| 22400+17a |
故答案为:NH3?H2O?NH4++OH-;
| 1000ab |
| 22400+17a |
(4)设M的相对原子质量为m,化合价为+x价,在氧化还原反应中,硝酸被还原为铵根离子,根据氧化还原反应中电子得失守恒可知,产生6.72L氨气,共转移的电子的物质量为
| 6.72 |
| 22.4 |
| 44.8 |
| m |
| 56 |
| 3 |
故答案为:8Fe+30H++3NO3-═8Fe3++3NH4++9H2O;4H2O(g)+3Fe(s)=Fe3O4(s)+4H2(g)△H=8aKJ/mol;
(5)①淀粉发生水解生成葡萄糖,化学方程式为:(C6H10O5)n+nH2O
| 催化剂 |
| △ |
故答案为:(C6H10O5)n+nH2O
| 催化剂 |
| △ |
②淀粉水解是在酸性条件下进行,产生葡萄糖,所以应先将溶液调成碱性,需要加氢氧化钠溶液,再通过检验葡萄糖中的醛基证明产物,需要加银氨溶液或新制氢氧化铜悬浊液,故选ac;
点评:本题主要考查了电子式、物质的量浓度的计算、氧化还原反应方程式、有机反应、实验设计等知识,难度较大,解题的难点是氨水的物质的量浓度计算及第(4)中的铁的推断.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
下列有关晶体的说法中正确的是( )
| A、某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 |
| B、原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 |
| C、区分晶体和非晶体最科学的方法是对固体进行X-射线衍射实验 |
| D、任何晶体中,若含有阳离子也一定含有阴离子 |
某温度下一定体积的密闭容器中发生如下反应:2A(g)+B(g)?2C(g),若开始时充入2mol A和2molB,达到平衡时,A的体积分数为w;若在相同条件下充入下列起始物料,则达到平衡时A体积分数小于w的是( )
| A、1mol A和1molB |
| B、2molC |
| C、3mol A和3molB |
| D、1molB和2molC |