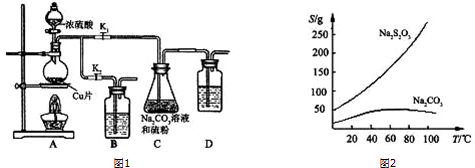
题目内容
10.在容积不变的密闭容器中,充入1 mol A气体、2 mol B气体和1 mol C气体,发生A+2 B?n C的反应,一段时间后达到平衡,此时C的物质的量是开始时的2.4倍,且增大压强会使A的转化率增大;升高平衡体系温度,再达平衡后体系中C的体积分数为13%,则下列判断错误的是( )| A. | n=2 | |
| B. | 第一次达平衡时,反应消耗的A为0.7 mol | |
| C. | 充入氮气后,反应速率加快,平衡正向移动 | |
| D. | 正反应放热 |
分析 增大压强会使A的转化率增大,说明增大压强平衡向着正向移动,该反应为气体体积缩小的反应,则n<1+2=3;达到平衡时C的物质的量是开始时的2.4倍,则平衡时C的物质的量为1mol×2.4=2.4mol,即平衡时生成1.4molC,n=1时消耗A的物质的量为1.4mol>1mol,不可能,结合n<3可知n只能为2,该反应为A+2 B?2C,利用差量法计算出原平衡时C的体积分数,根据升温后C的体积分数变化判断反应热,据此进行解答.
解答 解:A.增大压强A的转化率增大,说明增大压强平衡向着正向移动,该反应为气体体积缩小的反应,则n<1+2=3;达到平衡时C的物质的量是开始时的2.4倍,则平衡时C的物质的量为1mol×2.4=2.4mol,即平衡时生成1.4molC,n=1时消耗A的物质的量为1.4mol>1mol,不可能,结合n<3可知n只能为2,故A正确;
B.第一次达平衡时生成1.4molC,根据反应A+2 B?2C可知反应消耗的A为:1.4mol×$\frac{1}{2}$=0.7 mol,故B正确;
C.容器容积不变,充入氮气后各组分的浓度不变,则反应速率、化学平衡都不变,故C错误;
D.第一次平衡时C的物质的量为2.4mol,反应生成了1.4molC,则
A+2 B?2C△n
1 2 2 1
1.4mol 0.7mol,
则平衡时气体总物质的量为:1mol+2mol+1mol-0.7mol=3.3mol,相同条件下气体体积分数=气体物质的量分数,则C的体积分数=$\frac{2.4mol}{3.3mol}$×100%≈72.7%,升高平衡体系温度,再达平衡后体系中C的体积分数为13%<72.7%,说明升高温度平衡向着逆向移动,则该反应为放热反应,故D正确;
故选C.
点评 本题考查了化学平衡的计算,题目难度中等,根据题干数据正确判断n为解答关键,注意掌握化学平衡及其影响,试题培养了学生的分析、理解能力及化学计算能力.

①CH3OH(g)+H2O(g)═CO2(g)+3H2(g)△H=+49.0kJ/mol
②CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9kJ/mol
下列说法正确的是( )
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 反应①要吸收热量,故反应②更实用些 | |
| C. | CH3OH转变成H2的过程一定要吸收能量 | |
| D. | 根据②推知反应:CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)的△H>-192.9kJ/mol |

| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |
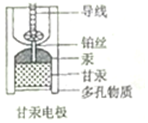 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
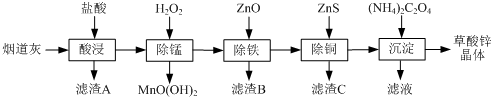
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
(1)滤渣A的主要成分为SiO2.
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为Mn2++H2O2+H2O=MnO(OH)2↓+2H+.
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为3.3~5.4.
②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是先加入ZnS会将Fe3+还原为Fe2+,使铁元素难以除去.
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中.
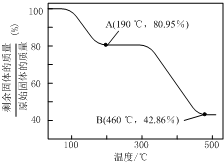
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如右图所示,300℃~460℃范围内,发生反应的化学方程式为ZnC2O4$\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO↑+CO2↑.