题目内容
5.在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)?3C(g)+2D(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol.请计算:
(1)5min末A的物质的量浓度.
(2)5min内D的平均化学反应速率.
(3)5min末B的转化率.
(4)反应后容器中的总压强与反应前容器中的总压强之比.
分析 (1)根据C的物质的量计算反应的A的物质的量,从而知道为反应的A的物质的量,再利用浓度公式计算;
(2)根据C的物质的量计算反应生成的D的物质的量,根据反应速率公式计算;
(3)根据转化率=$\frac{消耗量}{起始量}$×100%计算5min末B的转化率;
(4)气体压强之比等于气体物质的量之比.
解答 解:(1)A(g)+2B(g)?3C(g)+2D(g),
起始量 4mol 6mol 0 0
变化量 1 mol 2 mol 3 mol 2mol
5min末 3 mol 4mol 3 mol 2mol
则5min末A的物质的量浓度为:c(A)=$\frac{3mol}{2L}$=1.5 mol/L,
答:5min末A的物质的量浓度为1.5 mol/L;
(2)5min内D的平均化学反应速率为:v(D)=$\frac{\frac{2mol}{2L}}{5min}$=0.2 mol/(L•min),
答:5min内D的平均化学反应速率0.2 mol/(L•min);
(3)5min末B的转化率为:$\frac{2mol}{6mol}$×100%=33.3%,
答:5min末B的转化率33.3%;
(4)气体压强之比等于气体物质的量之比,反应后容器中的总压强与反应前总压强之比=(3+4+3+2):(4+6)=12:10=6:5,
答:反应后容器中的总压强与反应前容器中的总压强之比为6:5.
点评 本题考查化学平衡的计算,题目难度中等,涉及反应速率、转化率、物质的量浓度的计算等知识,明确反应速率、转化率、物质的量浓度的概念及表达式即可解答,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.

 快乐5加2金卷系列答案
快乐5加2金卷系列答案| A. | 126C和146C是2种核素,他们互称同位素 | |
| B. | 近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体 | |
| C. |  与 与 互为同分异构体 互为同分异构体 | |
| D. | 硝基苯可看成是由  和-NO2两种基团组成 和-NO2两种基团组成 |
| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |
| A. | n=2 | |
| B. | 第一次达平衡时,反应消耗的A为0.7 mol | |
| C. | 充入氮气后,反应速率加快,平衡正向移动 | |
| D. | 正反应放热 |
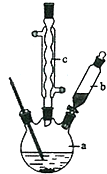
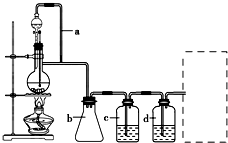 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
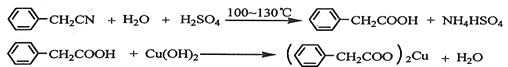
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: