题目内容
11.某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Fe2+和Na+.某同学为了确认其成分,取部分溶液,设计并完成了如图实验:下列说法正确的是( )
| A. | 原溶液中c(Fe3+)=0.2mol•L-1 | |
| B. | SO42-、NH4+、Na+一定存在,CO32-一定不存在 | |
| C. | 要确定原溶液中是否含有Fe2+,其操作为取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ | |
| D. | 溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol•L-1 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,该气体为氨气,原溶液中一定存在0.02molNH4+;
产生的红褐色沉淀为氢氧化铁,1.6g固体为三氧化二铁,氧化铁的物质的量为0.01mol,则原溶液中含有0.02mol铁元素,可能为Fe3+、Fe2+,原溶液中一定没有CO32-;
滤液通入二氧化碳无现象,则原溶液中一定不存在Al3+;
4.66g不溶于盐酸的固体为硫酸钡,硫酸钡的物质的量为0.02mol,原溶液中含有0.02mol硫酸根离子;
颜色反应为黄色,则溶液中存在钠离子,由于加入了氢氧化钠溶液,无法判断原溶液中是否含有钠离子;
根据溶液电中性判断是否存在氯离子,以此解答该题.
解答 解:A.根据以上分析可知,原溶液中含有0.02mol铁元素,无法判断存在的是铁离子或者亚铁离子,故A错误;
B.根据以上分析可知,原溶液中一定存在SO42-、NH4+、Cl-,只是存在Fe3+、Fe2+中的一种,其离子的物质的量为0.02mol,一定不存在CO32-;由于第一步中加入了氢氧化钠溶液,引进了钠离子,无法确定原溶液中是否含有钠离子,故B错误;
C.检验亚铁离子时,取少量原溶液于试管中,加KSCN溶液,此时溶液现象必须是无色,然后再加入适量氯水,溶液呈血红色,则含有Fe2+,否则如果加入硫氰化钾溶液后显示红色,则无法证明原溶液中是否含有亚铁离子,故C错误;
D.根据以上分析,原溶液中一定存在0.02molNH4+,0.02molSO42-,0.02molFe3+、Fe2+中的一种,当铁元素全部为亚铁离子时,阳离子所带电荷的物质的量最小,所以正电荷物质的量最少为:0.02mol×2+0.02mol=0.06mol,而负电荷的物质的量为:0.02mol×2=0.04mol,根据溶液电中性可知,原溶液中一定存在Cl-,且c(Cl-)≥$\frac{0.06mol-0.04mol}{0.1L}$=0.2 mol•L-1,故D正确.
故选D.
点评 本题考查物质分离、提纯实验方案的设计,为高频考点,把握实验流程中的试剂、发生的反应及分离方法为解答的关键,侧重分析能力、实验能力的综合考查,题目难度不大,注意根据溶液电中性判断氯离子存在的方法.

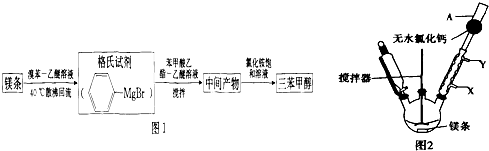
已知:Ⅰ)格氏试剂容易水解:
 +H2O→
+H2O→ +Mg(OH)Br(碱式溴化镁)
+Mg(OH)Br(碱式溴化镁)Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
请回答以下问题:
(1)实验室合成三苯甲醇的装置如图2,写出玻璃仪器A的名称干燥管,装有无水CaCl2的仪器A的作用是防止空气中的水蒸气进入装置,避免格氏试剂水解.
(2)制取格氏试剂时要保持微沸,可以采用水浴加热,优点是受热均匀,便于控制温度,微沸回流时冷凝管中水流的方向是X→Y(填“X→Y”或“Y→X”).
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁、氯化铵等杂质,可以设计如下提纯方案,请填写空白:
粗产品$\stackrel{操作①}{→}$$\stackrel{②溶解、过滤}{→}$$\stackrel{③洗涤、干燥}{→}$ 三苯甲醇
其中,操作①为:蒸馏;洗涤液最好选用:A.
A.水B.乙醚C.乙醇D.苯
检验产品已经洗涤干净的操作为取少量最后一次洗涤液于试管中,滴加硝酸银溶液,若无沉淀生成,则已洗涤干净,反之则未洗涤干净.
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80mL(标准状况).产品中三苯甲醇质量分数为(保留两位有效数字).若配成乙醇溶液,来测三苯甲醇质量分数90%,结果会偏高(填“偏高”、“不变”或“偏低”).
| A. | 1000mL 2.5mol/L NaCl 溶液 | B. | 300mL 5mol/L KClO3溶液 | ||
| C. | 250mL 1mol/L AlCl3溶液 | D. | 200mL 2mol/L MgCl2 溶液 |
| A. | 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
| A. | 126C和146C是2种核素,他们互称同位素 | |
| B. | 近期化学研究者开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫”,它外形类似海绵,比重极小,并具有磁性.纳米泡沫碳与C60互称同素异形体 | |
| C. |  与 与 互为同分异构体 互为同分异构体 | |
| D. | 硝基苯可看成是由  和-NO2两种基团组成 和-NO2两种基团组成 |
| A. | 称取8.0g硫酸铜,加入500mL水 | |
| B. | 称取12.0g胆矾配成500mL溶液 | |
| C. | 定容摇匀后液面下降,应加水至凹液面最低点与刻线相平 | |
| D. | 定容时仰视刻线会使所配溶液浓度偏小 |
| A. | n=2 | |
| B. | 第一次达平衡时,反应消耗的A为0.7 mol | |
| C. | 充入氮气后,反应速率加快,平衡正向移动 | |
| D. | 正反应放热 |

