题目内容
8.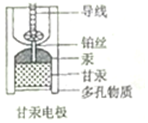 饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )
饱和甘汞电极(Hg-Hg2Cl2)因其电动势稳定,常被用作参比电极,其内部构造如图所示,当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,下列说法正确的是( )| A. | 负极的电极反应式为Zn-2e-═Zn2+ | |
| B. | 正极的电极反应式为Hg2Cl2+2e-═2Hg+2Cl- | |
| C. | 多孔物质相当于盐桥 | |
| D. | 甘汞电极中,Cl-既不是反应物,也不是产物 |
分析 A.原电池中,负极失电子发生氧化反应;
B.原电池中,正极得电子发生还原反应;
C.多孔物质是与被测溶液接触的通道;
D.根据正极反应式判断;
解答 解:A、当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,锌失电子而作负极,电极反应式为Zn-2e-═Zn2+,故A正确;
B、当甘汞电极与锌共同插入ZnCl2溶液中构成原电池时,正极为甘汞电极,电极反应式为Hg2Cl2+2e-═2Hg+2Cl-,故B正确;
C、多孔物质是与被测溶液接触的通道,与盐桥作用不同,故C错误;
D.因为正极为甘汞电极,电极反应式为Hg2Cl2+2e-═2Hg+2Cl-,所以甘汞电极中,Cl-是产物,故D错误;
故选AB.
点评 本题考查原电池原理,根据原电池正负极上得失电子来分析解答即可,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列说法正确的是( )
| A. | 1 mol硫酸与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,所以CO的燃烧反应一定是吸热反应 | |
| D. | 25℃、101 kPa时,1 mol S和2 mol S的燃烧热相等 |
16.实验室里需用480mL 0.1mol•L-1的硫酸铜溶液,以下说法正确的是( )
| A. | 称取8.0g硫酸铜,加入500mL水 | |
| B. | 称取12.0g胆矾配成500mL溶液 | |
| C. | 定容摇匀后液面下降,应加水至凹液面最低点与刻线相平 | |
| D. | 定容时仰视刻线会使所配溶液浓度偏小 |
10.在容积不变的密闭容器中,充入1 mol A气体、2 mol B气体和1 mol C气体,发生A+2 B?n C的反应,一段时间后达到平衡,此时C的物质的量是开始时的2.4倍,且增大压强会使A的转化率增大;升高平衡体系温度,再达平衡后体系中C的体积分数为13%,则下列判断错误的是( )
| A. | n=2 | |
| B. | 第一次达平衡时,反应消耗的A为0.7 mol | |
| C. | 充入氮气后,反应速率加快,平衡正向移动 | |
| D. | 正反应放热 |
 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验:
连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂.某课题小组进行如下实验: