题目内容
3.硫酸铜溶液常用于农业上制波尔多液.下图是用废铜料(铁、铜混合物)来生产硫酸铜的过程,请根据图1回答下列问题.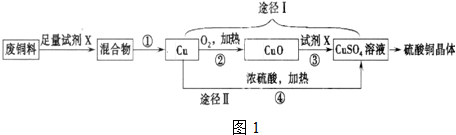
(1)试剂X的化学式为H2SO4,操作①的名称为过滤.
(2)甲同学认为途径Ⅰ比途径Ⅱ更为合理,其理由是ad(填编号)
a.对环境污染少 b.反应速率快
c.铜的利用率高 d.硫酸的利用率高
(3)实验室用浓硫酸与铜反应,采用下列装置(图2)制备并收集干燥的SO2气体.

①A装置的名称分液漏斗.
②连接上述仪器的正确顺序是(填各接口处的字母):a接d,e接b(f),c(g)接g(b),f(c)接h.
分析 加入的X需将铁除去,且不能与铜反应选择稀硫酸,反应①为铁与硫酸反应生成硫酸亚铁和氢气,化学方程式为Fe+H2SO4 ═FeSO4+H2↑,过滤后铜与氧气反应②为:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO,转化为氧化铜,反应③CuO+H2SO4═CuSO4+H2O;途径Ⅱ,在加热条件下,Cu和浓硫酸发生氧化还原反应生成CuSO4、SO2、H2O,反应方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(1)加入的X需将铁除去,且不能与铜反应选择稀硫酸,固液分离用过滤操作;
(2)途径Ⅰ:2Cu+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO,转化为氧化铜,CuO+H2SO4═CuSO4+H2O没有二氧化硫产生,硫酸的利用率高,无污染;
(3)①A装置为分液漏斗,在该装置中滴加浓硫酸;
②若要收集满干燥的SO2气体,装置排列顺序为:气体发生装置、干燥装置、收集装置、检验装置、尾气处理装置;
解答 解:(1)废铜料中有铁和铜,要生产硫酸铜,需将铁除去,因此可加入足量稀硫酸将铁除去,铜与硫酸不反应,过滤后得到固体铜,
故答案为:H2SO4;过滤;
(2)途径Ⅱ是铜与浓硫酸反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O生成硫酸铜、二氧化硫和水,二氧化硫为有毒气体,且浪费硫酸,因此对比途径I、Ⅱ,途径Ⅰ没有二氧化硫产生,硫酸的利用率高,无污染,
故答案为:ad;
(3)①装置A、a,用浓硫酸与铜反应制取二氧化硫,装置A为分液漏斗,用于滴加浓硫酸,
故答案为:分液漏斗;
②制取干燥的SO2气体,装置排列顺序为:气体发生装置、干燥装置、收集装置、检验装置、尾气处理装置,A、a 为气体发生装置、b、c(f、g)为收集装置、d、e用浓硫酸是干燥装置、f、g(b、c)是防倒吸装置、h是尾气处理装置,所以排列顺序是debcgfh或defgbch,
故答案为:debcgf或defgbc;
点评 本题考查硫酸铜、二氧化硫的制备,侧重考查学生实验操作、分析能力,会根据实验目的排列装置顺序,易错选项是(3)③,注意酸性条件下硝酸根离子的性质、硫元素的化合价变化,题目难度中等.

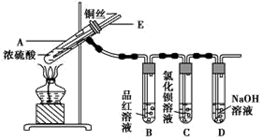
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液褪色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面.
请回答下列问题:
(1)A试管中发生反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)能够证明铜与浓硫酸反应生成气体的实验现象是B试管中品红溶液褪色.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置.
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
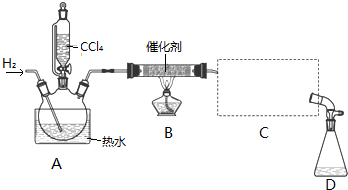
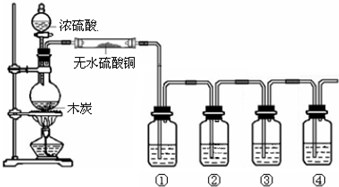
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
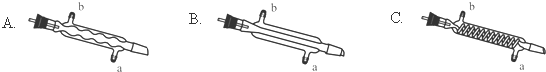
(3)C处中应选用的冷凝管为B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.
反应原理:
相关资料:
| 名称 | 相对分子质量 | 性状 | 熔点/℃ | 溶解度 | |
| 水 | 乙醇 | ||||
| 甲苯 | 92 | 无色液体易烯易挥发 | -95 | 不溶 | 易溶 |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4(100℃升华) | 25℃0.35g 80℃2.7g | 易溶 |
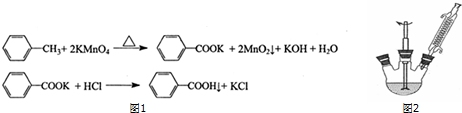
①如图2组装反应装置(冷凝水、夹持及加热装置未画出),并在三颈烧瓶中依次加入120mL水、稍过量高锰酸钾和3.0mL甲苯(密度为0.866g/mL).
②将三颈烧瓶中的混合液体搅拌、加热至沸腾,直到甲苯完全反应.
③趁热过滤反应混合物.若滤液呈紫色,则需加入适量的亚硫酸氢钠溶液至紫色褪去后再过滤,用热水洗涤滤渣,洗涤液合并至滤液中.
④用冰水冷却滤液,然后用浓盐酸酸化,过滤,用少量冷水洗涤滤渣,得到苯甲酸粗产品,经重结晶得到精制的苯甲酸.
回答下列问题:
(1)仪器 a名称为(蛇形)冷凝管.
(2)判断甲苯己完全反应的现象是三颈烧瓶中混合液不再分层、回流液不再出现油珠.
(3)实验步骤④中,用少量冷水而不用热水洗涤滤渣的目的是减少苯甲酸因溶解造成损失;苯甲酸粗产品除了可用重结晶法精制外,还可用升华法.
(4)精制的苯甲酸纯度测定:称取1.220g样品,用稀乙醇溶解并配成100mL溶液,分别取25.00mL溶液,用0.1000mo1•L-1NaOH标准溶液滴定,三次滴定消耗NaOH溶液的体积分别为V1=22.48mL.V2=22.52mL.V3=23.80mL.
①配制溶液时用稀乙醇而不用蒸馏水作溶剂的原因是常温下苯甲酸微溶于水而易溶于乙醇.
②若用酚酞作指示剂,确定滴定终点的现象是滴加最后一滴氢氧化钠标准溶液后,溶液由无色变为浅红色,且30秒不褪色.
③产品的纯度为90%.
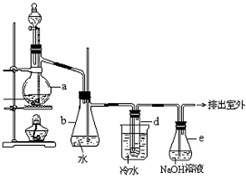 醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;
醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷的装置如下图所示,试管d中装有少量蒸馏水.已知溴乙烷的沸点为38.4oC,密度为1.43g•ml-1;