题目内容
8.氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化.实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如图: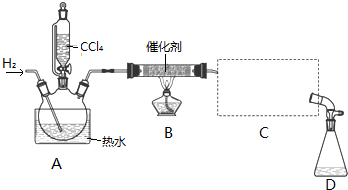
| 物质 | 相对分子质量 | 密度/(g•mL-1) | 沸点/℃ | 水中溶解性 |
| CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
| CCl4 | 154 | 1.59 | 76.7 | 难溶 |
①检验装置气密性;
②开始通入H2;
③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水;
⑤向三颈瓶中滴入20mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15g.请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化.
(2)B处中发生主要反应的化学方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl.
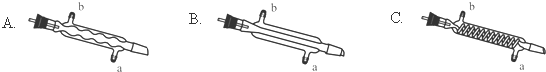
(3)C处中应选用的冷凝管为B(填选项字母);冷水应从该冷凝管的a(填“a”或“b”)口接入.
(4)步骤⑥中,用水洗涤的目的为洗掉NaHCO3和NaCl.
(5)该实验中,氯仿的产率为61%.
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为2CHCl3+O2=2COCl2+2HCl.
分析 (1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下;冷却水采用逆流的方式冷却效果较好;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可书写化学方程式.
解答 解:(1)若步骤②和步骤③的顺序颠倒,则装置中有空气,通入氢气再加热,容易发生爆炸,同时装置中的空气也能氧化氯仿,
故答案为:加热时氢气遇氧气发生爆炸、生成的氯仿被氧气氧化;
(2)装置B中是四氯化碳与氢气发生取代反应生成三氯甲烷和氯化氢,反应方程式为CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl,
故答案为:CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl;
(3)蒸馏装置中通常选用直形冷凝管,便于液体流下,故选B,冷却水采用逆流的方式冷却效果较好,所以冷水应从该冷凝管的a口接入,
故答案为:B;a;
(4)收集到的液体先用适量NaHCO3溶液洗涤,此时会有NaHCO3和NaCl杂质,所以要用水再洗涤,用以洗掉NaHCO3和NaCl,
故答案为:洗掉NaHCO3和NaCl;
(5)20mLCCl4的质量为31.8g,其物质的量为0.206mol,根据反应CCl4+H2$→_{△}^{催化剂}$CHCl3+HCl可知,理论上应生成的物质的量为0.206mol,即质量为24.6g,根据产率=$\frac{15g}{24.6g}$×100%=61%,
故答案为:61%;
(6)氯仿在空气中被氧气氧化生成HCl和光气(COCl2),根据元素守恒可知化学方程式为2CHCl3+O2=2COCl2+2HCl,
故答案为:2CHCl3+O2=2COCl2+2HCl.
点评 本题考查了物质制备方案的设计,题目难度中等,涉及仪器的使用、化学实验基本操作方法、化学计算等知识,试题知识点较多、综合性较强,充分考查了学生的化学实验、化学计算能力.

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案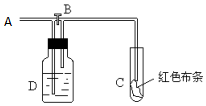 如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )
如图:A处通入氯气.打开B阀时,C处红色布条无变化,关闭B阀时,C处干燥的红色布条褪色.由此作出的判断正确的是( )a.D中不可能是浓硫酸 b.D中可以是少量水
c.通入的氯气含有水蒸气 d.D中可以是饱和食盐水.
| A. | abc | B. | bcd | C. | abd | D. | abcd |
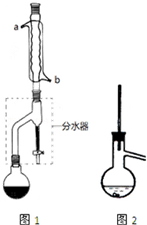 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好.在分水器中预先加入5.00mL水,其水面低于分水去回流支管下沿3~5mm,然后用小火加热,反应大约40min.
Ⅱ分离提纯:
①%2当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分震荡后静置,分去水层.
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO4•7H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
2CH3CH2CH2CH2OH $?_{△}^{浓H_{2}SO_{4}}$CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式CH3CH2CH2CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH2CH2CH3+H2O.
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从b(填a或b)管口通入.
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、乙酸、正丁醇.
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先过滤(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有正丁醚杂质.
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在bd中加热比较合适(请从下列选项中选择).
A.水 B.甘油(沸点290℃) C.沙子 D.石蜡油(沸点200~300℃)
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为88%.
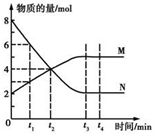
| A. | 反应的化学方程式为2 M?N | |
| B. | t2 min时,正逆反应速率相等,反应达到平衡 | |
| C. | t3 min后,正逆反应仍在进行 | |
| D. | t3~t4 min时,v正(N)=v逆(M) |
| A. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) | |
| B. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| C. | AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | |
| D. | pH=4.0的番茄汁中c(H+)是pH=6.0的牛奶中c(H+)的100倍 |
 浓硫酸是一种重要的化工产品.
浓硫酸是一种重要的化工产品.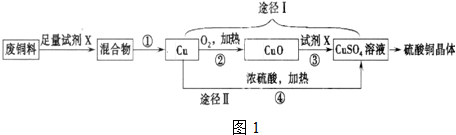

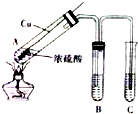
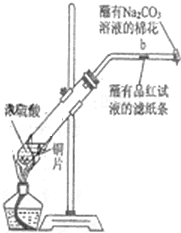 如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答:
如图所示,将6.4g铜与12mL18mol•L-1浓硫酸在试管a中共热.据此回答: