题目内容
19.将5.60g铁投入100mL某浓度的盐酸中,铁和盐酸恰好完全反应.求:(1)5.60g铁的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积.
分析 (1)根据n=$\frac{m}{M}$计算物质的量;
(2)发生Fe+2HCl=FeCl2+H2↑,列出铁与盐酸物质的量的关系式,结合c=$\frac{n}{V}$以此计算;
(3)发生Fe+2HCl=FeCl2+H2↑,列出铁与氢气物质的量的关系式以此计算.
解答 解:(1)n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
答:5.6g铁的物质的量为0.1mol;
(2)设盐酸的物质的量为xmol,由反应Fe+2HCl=FeCl2+H2↑可知,
Fe+2HCl=FeCl2+H2↑
1 2
0.1mol xmol
则$\frac{1}{0.1mol}=\frac{2}{xmol}$
故有x=0.2mol
即则c(HCl)=$\frac{0.2mol}{0.1L}$=0.2mol/L
答:所用盐酸中HCl的物质的量浓度为0.2mol/L;
(3)设生成氢气的物质的量为ymol,根据反应可知:
Fe+2HCl=FeCl2 +H2↑
1 1
0.1mol ymol
则有:$\frac{1}{0.1mol}=\frac{1}{ymol}$
解得y=0.1mol
即n(H2)=0.1mol,标况下体积V=0.1mol×22.4L/mol=2.24L,
答:生成的H2在标准状况下的体积为2.24L.
点评 本题考查化学反应方程式的计算,为高频考点,把握发生的氧化还原反应为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
9.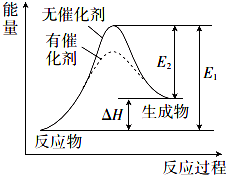 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列说法错误的是( )| A. | 该反应为吸热反应 | |
| B. | 催化剂不能改变反应的焓变(△H) | |
| C. | 催化剂能降低反应的活化能 | |
| D. | 逆反应的活化能大于正反应的活化能 |
10.符合图中阴影部分的物质是( )


| A. | K2SO3 | B. | K2S2O3 | C. | K2 SO4 | D. | KHSO4 |
7.下列溶液中Cl-的物质的量最多的是( )
| A. | 200mL 2mol/L MgCl2溶液 | B. | 150mL 5mol/L KClO3溶液 | ||
| C. | 标准状况下,13.44L的HCl气体 | D. | 29.25gNaCl固体 |
14.碳酸钠(Na2CO3)俗名纯碱,属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
11.乙酸丁酯(CH3COOCH2CH2CH2CH3)是具有果香味的香精,经酯化反应可进行乙酸丁酯的合成.有关物质的物理性质见表.合成过程如下:第一步:将丁醇和过量的乙酸混合加热发生酯化反应;第二步:洗涤提纯;第三步:蒸馏提纯.
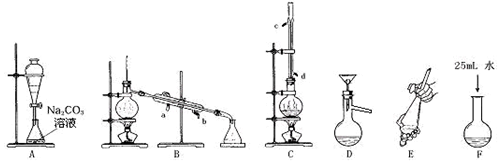
(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
| 乙酸 | 1-丁醇 | 乙酸丁酯 | |
| 熔点/℃ | 16.6 | -89.5 | -73.5 |
| 沸点/℃ | 117.9 | 117 | 126.3 |
| 密度/g•cm-3 | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 互溶 | 不溶 |

(1)上述是合成和提纯乙酸丁酯的有关装置图,请写出合成和提纯乙酸丁酯的操作顺序(填字母)
C→F→E→A→D→B.
(2)C装置中除了装有1-丁醇和过量的乙酸外,还需要加入浓硫酸、沸石.装置C中冷凝管的作用是:冷凝回流挥发的乙酸和丁醇;
(3)步骤F:酯化反应完成后,向卸下的烧瓶中加入25mL水的作用是溶解吸收未反应的酸和醇.A装置中Na2CO3溶液的作用是除去乙酸丁酯中过量的乙酸.
(4)装置A的分液漏斗中液体分为两层,乙酸丁酯应在上(填上、下)层.
(5)第一步酯化反应过程中可能得到的有机副产物有CH2=CH-CH2-CH3,CH3-CH2-CH2-CH2-O-CH2-CH2-CH2-CH3(写出两种物质的结构简式).
8.实验室欲配制480mL浓度为0.1mol•L-1的Na2CO3溶液,下列操作可以实现的是( )
| A. | 称量5.3 g Na2CO3固体溶于480 mL水配制成溶液 | |
| B. | 称量5.3 g Na2CO3固体溶于水配制成0.5 L溶液 | |
| C. | 称量5.3 g Na2CO3•10H2O晶体溶于水配制成0.5 L溶液 | |
| D. | 称量5.3 g Na2CO3•10H2O晶体溶于0.5 L水配制成溶液 |