题目内容
2.已知反应A(g)+B(g)?C(g)+D(g)的平衡常数K值与温度的关系如表所示.830℃时,向一个2L的密闭容器中充入0.20mol A和0.20mol B,10s时达平衡.下列说法不正确的是( )| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反应初始至平衡,A的平均反应速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大压强,正、逆反应速率均加快 | |
| C. | 该反应正向为吸热反应,升高温度,K值增大,平衡正向移动 | |
| D. | 达到平衡后,B的转化率为50% |
分析 830℃时,K=1.0,向一个2L的密闭容器中充入0.20mol A和0.20mol B,10s时达平衡,设转化的A为xmol,则
A(g)+B(g)?C(g)+D(g)
开始 0.2 0.2 0 0
转化 x x x x
平衡0.2-x 0.2-x x x
$\frac{x×x}{(0.2-x)×(0.2-x)}$=1.0,解得x=0.1,
A.结合v=$\frac{△c}{△t}$计算;
B.增大压强,正逆反应速率增大;
C.由表格数据可知,温度越大,K越小,则正反应为放热反应;
D.结合转化率=$\frac{转化的量}{开始的量}$×100%.
解答 解:830℃时,K=1.0,向一个2L的密闭容器中充入0.20mol A和0.20mol B,10s时达平衡,设转化的A为xmol,则
A(g)+B(g)?C(g)+D(g)
开始 0.2 0.2 0 0
转化 x x x x
平衡0.2-x 0.2-x x x
$\frac{x×x}{(0.2-x)×(0.2-x)}$=1.0,解得x=0.1,
A.反应初始至平衡,A的平均反应速率v(A)=$\frac{\frac{0.1mol}{2L}}{10s}$=0.005 mol•L-1•s-1,故A正确;
B.增大压强,正逆反应速率增大,该反应中正逆反应速率同等程度增大,故B正确;
C.由表格数据可知,温度越大,K越小,则正反应为放热反应,则升高温度,K值减小,平衡逆向移动,故C错误;
D.达到平衡后,B的转化率为$\frac{转化的量}{开始的量}$×100%=$\frac{0.1mol}{0.2mol}$×100%=50%,故D正确;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意表格中信息的应用,题目难度不大.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案| A. | 在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 | |
| B. | 实验室制用乙醇与浓硫酸制乙烯时,迅速升温到140℃ | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚,用水洗涤 | |
| D. | 取加热至亮棕色的纤维素水解液少许,滴入新制的氢氧化铜悬浊液加热,证明水解产物为葡萄糖 |
| A. | 甲同学说:该条件下NaHCO3的溶解度较小 | |
| B. | 乙同学说:NaHCO3不是纯碱 | |
| C. | 丙同学説:析出NaHCO3固体后的溶液中只含氯化铵和氯化钠 | |
| D. | 丁同学说:从该反应可以获得氮肥 |
| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
| A. | 1min内用O2表示的反应速率为0.03 mol•L-1•min-1 | |
| B. | 该反应的平衡常数数值为7.5 | |
| C. | SO2的平衡转化率为60% | |
| D. | 降低温度,SO2平衡浓度减小 |
| A. | 碱式滴定管用蒸馏水洗净后,直接注入标准浓度的NaOH溶液 | |
| B. | 碱式滴定管尖端有气泡,滴定后气泡消失 | |
| C. | 记录消耗的碱液,滴定前平视,滴定后俯视凹液面 | |
| D. | 锥形瓶用蒸馏水洗净后,直接装入未知浓度的盐酸 |
| A. | 寒冷的干冰 | B. | 清清的海水 | C. | 清新的空气 | D. | 坚硬的大理石 |
 .
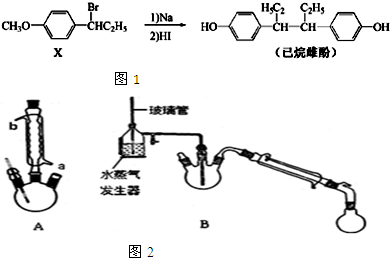
.
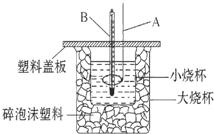 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.
已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.回答有关中和反应的问题.