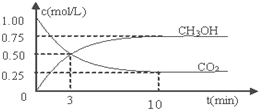
题目内容
17.在一定条件下发生反应:A(g)+B(g)?xC(g)+D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )| A. | A和B的转化率均是20% | B. | x=4 | ||
| C. | 平衡时A的物质的量为3.2mol | D. | 平衡时气体压强比原来减小 |
分析 4molA和2molB混合,2min后达到平衡时生成1.6molC,v(C)=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),又测得反应速率VD=0.2mol/(L•min),由反应速率之比等于化学计量数之比可知,x=2,则
A(g)+B(g)?2C(g)+D(g)
开始 4 2 0 0
转化 0.8 0.8 1.6 0.8
平衡 3.2 1.2 1.6 0.8
以此来解答.
解答 解:4molA和2molB混合,2min后达到平衡时生成1.6molC,v(C)=$\frac{\frac{1.6mol}{2L}}{2min}$=0.4mol/(L•min),又测得反应速率VD=0.2mol/(L•min),由反应速率之比等于化学计量数之比可知,x=2,则
A(g)+B(g)?2C(g)+D(g)
开始 4 2 0 0
转化 0.8 0.8 1.6 0.8
平衡 3.2 1.2 1.6 0.8
A.A的转化率为$\frac{0.8mol}{4mol}$×100%=20%,B的转化率为$\frac{0.8mol}{2mol}$×100%=40%,故A错误;
B.由速率之比等于化学计量数之比可知x=2,故B错误;
C.由上述计算可知平衡时A的物质的量为3.2mol,故C正确;
D.该反应为气体体积增大的反应,则平衡时气体压强比原来大,故D错误;
故选C.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、转化率计算等为解答的关键,侧重分析与计算能力的考查,注意化学计量数x的确定,题目难度不大.

| 选项 | 参数 | 比较 | 解释 |
| A | 沸点 | HF<HCl<HI | 组成结构相似的物质,相对分子质量越大沸点越高 |
| B | 半径 | Na+>Al3+>S2- | 同一周期粒子半径随原子序数的递增逐渐减小 |
| C | 酸性 | H2SO3>H2CO3 | 元素的非金属性越强,其含氧酸的酸性越强 |
| D | 还原性 | P3->S2->Cl- | 元素的非金属性越强,简单阴离子的还原性越弱 |
| A. | A | B. | B | C. | C | D. | D |
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反应初始至平衡,A的平均反应速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大压强,正、逆反应速率均加快 | |
| C. | 该反应正向为吸热反应,升高温度,K值增大,平衡正向移动 | |
| D. | 达到平衡后,B的转化率为50% |
| A. | W在元素周期表中位于第三周期第IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的常见离子化合物,其阳离子与阴离子个数比可能为1:1 |
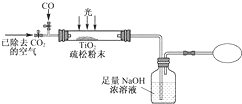
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
 ;该反应的类型为取代.
;该反应的类型为取代.