题目内容
13.下列实验操作正确的是( )| A. | 在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,配制新制氢氧化铜悬浊液,检验醛基 | |
| B. | 实验室制用乙醇与浓硫酸制乙烯时,迅速升温到140℃ | |
| C. | 盛放过苯酚的试剂瓶中残留的苯酚,用水洗涤 | |
| D. | 取加热至亮棕色的纤维素水解液少许,滴入新制的氢氧化铜悬浊液加热,证明水解产物为葡萄糖 |
分析 A.新制氢氧化铜悬浊液呈碱性;
B.140℃时乙醇发生取代反应生成乙醚,170℃时乙醇发生消去反应生成乙烯;
C.苯酚不易溶于水,当温度高于65℃时,能与水互溶;
D.纤维素水解在酸性条件下,要检验水解产物葡萄糖需要在碱性条件下.
解答 解:A.新制氢氧化铜悬浊液呈碱性,其配置方法为在2mL10%的氢氧化钠溶液中滴入2%的硫酸铜溶液4~6滴,故A正确;
B.140℃时乙醇发生取代反应生成乙醚,170℃时乙醇发生消去反应生成乙烯,所以温度不正确,故B错误;
C.苯酚不易溶于水,当温度高于65℃时,能与水互溶,但苯酚能溶于NaOH溶液,应该用NaOH溶液洗涤,故C错误;
D.纤维素水解在酸性条件下,要检验水解产物葡萄糖需要在碱性条件下,所以在加入新制氢氧化铜悬浊液之前必须加入NaOH中和未反应的酸,否则无法实现实验目的,故D错误;
故选A.
点评 本题考查化学实验评价,为高频考点,涉及物质检验、溶液配制、仪器洗涤、物质制备等知识点,明确实验原理及物质性质是解本题关键,注意D中加入试剂先后顺序,为易错点.

练习册系列答案
相关题目
3.控制变量法是化学实验中的一种常用方法,如表是某课外兴趣小组研究等物质的量浓度的稀硫酸和锌反应的实验数据(计算结果精确到小数点后一位),分析以下数据,回答下列问题:
(1)实验①和实验②表明温度对反应速率有影响,对这一规律进行研究的实验还有一组是③和④(填实验序号).研究锌的形状对反应速率的影响时,我们最好选取实验②、③和⑤(填3个实验序号).上述实验发生反应的化学方程式为Zn+H2SO4(稀)=ZnSO4+H2↑.
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
| 序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
| ① | 50.0 | 2.0 | 薄片 | 15 | 200 | m1 |
| ② | 50.0 | 2.0 | 薄片 | 25 | 100 | m2 |
| ③ | 50.0 | 2.0 | 颗粒 | 25 | 70 | m3 |
| ④ | 50.0 | 2.0 | 颗粒 | 35 | 35 | m4 |
| ⑤ | 50.0 | 2.0 | 粉末 | 25 | t1 | 5.0 |
| ⑥ | 50.0 | 4.0 | 粉末 | 25 | t2 | m5 |
| ⑦ | 50.0 | 6.0 | 粉末 | 25 | t3 | 14.9 |
| ⑧ | 50.0 | 8.0 | 粉末 | 25 | t4 | 19.3 |
| ⑨ | 50.0 | 10.0 | 粉末 | 25 | t5 | m6 |
| ⑩ | 50.0 | 12.0 | 粉末 | 25 | t6 | 19.3 |
(2)下列数据推断正确的是AD
A.t1<70 B.t1>t4 C.m1<m2 D.m6=19.3
(3)若采用与实验①完全相同的条件,但向反应窗口中滴加少量硫酸铜溶液,发现反应速率明显加快,原因是CuSO4与Zn反应产生的Cu,Cu与Zn形成铜锌原电池,加快了H2产生的速率.
(4)硫酸的物质的量浓度是2.4mol/L,实验⑥生成的硫酸锌的质量m5=9.9g.
1.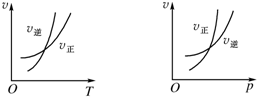 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
 可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )
可逆反应mA(g)?nB(g)+pC(g)△H=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )| A. | m<n+p,Q>0 | B. | m>n+p,Q>0 | C. | m<n+p,Q<0 | D. | m>n+p,Q<0 |
18.下列关于Li、Na、K、Rb性质的比较,不正确的是( )
| A. | 它们的原子核外电子层数随质子数的增加而增多 | |
| B. | 它们的L层电子数都相同 | |
| C. | 它们的原子核对最外层电子的引力逐渐减弱 | |
| D. | 它们与氧气或水反应时越来越剧烈 |
2.已知反应A(g)+B(g)?C(g)+D(g)的平衡常数K值与温度的关系如表所示.830℃时,向一个2L的密闭容器中充入0.20mol A和0.20mol B,10s时达平衡.下列说法不正确的是( )
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反应初始至平衡,A的平均反应速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大压强,正、逆反应速率均加快 | |
| C. | 该反应正向为吸热反应,升高温度,K值增大,平衡正向移动 | |
| D. | 达到平衡后,B的转化率为50% |
3.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.
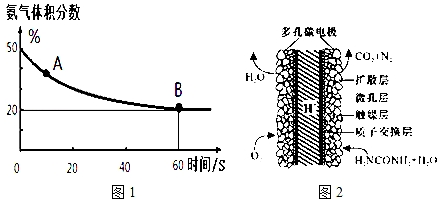
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;(填具体数值)NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.

A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;(填具体数值)NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
 ,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
,由上述实验可知,该溶液中可以肯定存在的离子有SO32-、S2-、CO32-.
 ;该反应的类型为取代.
;该反应的类型为取代.