题目内容
12.下列物质属于纯净物的是( )| A. | 寒冷的干冰 | B. | 清清的海水 | C. | 清新的空气 | D. | 坚硬的大理石 |
分析 只由一种物质构成的是纯净物,由两种或两种以上物质构成的是混合物,据此分析.
解答 解:A、干冰是固态二氧化碳,是纯净物,故A正确;
B、海水中含有大量的食盐和矿物质,是混合物,故B错误;
C、空气是氮气和氧气的和其它的少量气体的混合物,故C错误;
D、大理石的主要成分为碳酸钙,还含有其它杂质,故是混合物,故D错误.
故选A.
点评 本题考查了生活中的常见物质的成分,难度不大,应注意纯净物和混合物的概念.

练习册系列答案
相关题目
2.已知反应A(g)+B(g)?C(g)+D(g)的平衡常数K值与温度的关系如表所示.830℃时,向一个2L的密闭容器中充入0.20mol A和0.20mol B,10s时达平衡.下列说法不正确的是( )
| 温度/℃ | 700 | 830 | 1200 |
| K值 | 1.7 | 1.0 | 0.4 |
| A. | 反应初始至平衡,A的平均反应速率v(A)=0.005 mol•L-1•s-1 | |
| B. | 增大压强,正、逆反应速率均加快 | |
| C. | 该反应正向为吸热反应,升高温度,K值增大,平衡正向移动 | |
| D. | 达到平衡后,B的转化率为50% |
3.尿素是蛋白质代谢的产物,也是重要的化学肥料.工业合成尿素反应如下:
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.
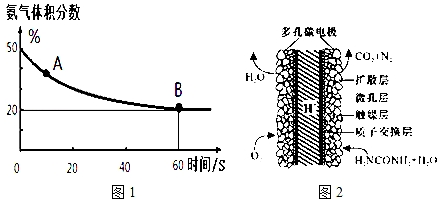
A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
①关于上述反应的焓变、熵变说法正确的是A.
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;(填具体数值)NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)
(1)在一个真空恒容密闭容器中充入CO2和NH3发生上述反应合成尿素,恒定温度下混合气体中的氨气含量如图1所示.

A点的正反应速率v正(CO2)>B点的逆反应速率v逆(CO2)(填“>”、“<”或“=”);氨气的平衡转化率为75%.
(2)氨基甲酸铵是合成尿素的一种中间产物.将体积比为2:1的NH3和CO2混合气体充入一个容积不变的真空密闭容器中,在恒定温度下使其发生下列反应并达到平衡:2NH3(g)+CO2(g)═NH2COONH4(s)将实验测得的不同温度下的平衡数据列于表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
A.△H<0,△S<0 B.△H>0,△S<0 C.△H>0,△S>0 D.△H<0,△S>0
②关于上述反应的平衡状态下列说法正确的是C
A.分离出少量的氨基甲酸铵,反应物的转化率将增大
B.平衡时降低体系温度,CO2的体积分数下降
C.NH3的转化率始终等于CO2的转化率
D.加入有效的催化剂能够提高氨基甲酸铵的产率
③氨基甲酸铵极易水解成碳酸铵,酸性条件水解更彻底.将氨基甲酸铵粉末逐渐加入1L0.1mol/L的盐酸溶液中直到pH=7(室温下,忽略溶液体积变化),共用去0.052mol氨基甲酸铵,此时溶液中几乎不含碳元素.此时溶液中c(NH4+)=0.1mol/L;(填具体数值)NH4+水解平衡常数值为4×10-9.
(3)化学家正在研究尿素动力燃料电池,尿液也能发电!用这种电池直接去除城市废水中的尿素,既能产生净化的水又能发电.尿素燃料电池结构如图2所示,写出该电池的负极反应式:CO(NH2)2+H2O-6e-═N2↑+CO2↑+6H+.
20.硅单质及其化合物应用范围很广.请回答下列问题
(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示.
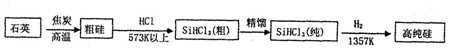
①写出由纯SiHCl3制备高纯硅的化学反应方程式SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2,可能引起的后果是高温下,H2遇O2发生爆炸.
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因:生成白色絮状沉淀,又刺激性气味的气体生成,SiO32-与NH4+发生双水解反应,生成氨气和硅酸沉淀.
①2O2(g)+N2(g)=N2O4,(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:1228.6.
(4)联氨为二元弱減,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为(已知:N2H4+H+?N2H5+的K=8.7×107;KW=1.0×10-14),.联氨与硫酸形成的酸式盐的化学式为N2H6(HSO4)2.
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生.联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O21 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4.
(1)制备硅半导体材料必须先得到高纯硅的主要方法,其生产过程示意图如图所示.

①写出由纯SiHCl3制备高纯硅的化学反应方程式SiHCl3+H2$\frac{\underline{\;1357K\;}}{\;}$Si+3HCl
②整个制备过程必须严格控制无水无氧.SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式,H2还原SiHCl3过程中若混入O2,可能引起的后果是高温下,H2遇O2发生爆炸.
(2)硅酸钠水溶液俗称水玻璃.取少量硅酸钠溶液于试管中,逐滴加入饱和氯化铵溶液,振荡.写出实验现象其产生原因:生成白色絮状沉淀,又刺激性气味的气体生成,SiO32-与NH4+发生双水解反应,生成氨气和硅酸沉淀.
①2O2(g)+N2(g)=N2O4,(l)△H1
②N2(g)+2H2(g)=N2H4(l)△H2
③O2(g)+2H2(g)=2H2O(g)△H3
④2N2 H4 (1)+N2O4 (1)=3N2 (g)+4H2O(g)△H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=2△H3-2△H2-△H1,联氨和N2O4可作为火箭助推剂,折算在标准状况下的数据,燃爆后气体的体积与燃爆前的体积之比为:1228.6.
| N2H4 | N2O4 | |
| 密度/g/cm3 | 1.004 | 1.44 |
(5)联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是固体逐渐变黑,并有气泡产生.联氨可用于处理锅炉水中的氧;防止锅炉被腐蚀,理论上1kg的联氨可除去水中溶解的O21 kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是N2H4的用量少,不产生其他杂质(反应产物为N2和H2O),而Na2SO3产生Na2SO4.
7.X、Y、Z、W是原子序数依次增大的短周期主族元素.已知X原子的最外层电子数是其所在周期数的2倍,X单质在Y单质中充分燃烧生成其最髙价化合物XY2,Z+与Y2-具有相同的电子数,W与Y同主族.下列说法正确的是( )
| A. | W在元素周期表中位于第三周期第IVA族 | |
| B. | X的最简单气态氢化物的热稳定性比Y的强 | |
| C. | 由X、Y、Z三种元素组成的物质水溶液一定呈碱性 | |
| D. | 由Y、Z两种元素组成的常见离子化合物,其阳离子与阴离子个数比可能为1:1 |
4.等体积的两容器内,一个盛N2和O2的混合气体,另一个盛NO,若容器内温度、压强相同,则两容器内所盛气体一定具有相同的( )
| A. | 质量 | B. | 原子数 | C. | 质子数 | D. | 密度 |
1.胶体区别于其他分散系的本质特征是( )
| A. | 胶体粒子直径在1~100nm之间 | B. | 胶体粒子带电荷 | ||
| C. | 胶体粒子能穿过滤纸 | D. | 胶体粒子能够发生布朗运动 |
 某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.
某小组欲探究Cl2与KI溶液的反应,设计实验装置如下图.