题目内容
1.某铁的氧化物(FexO)1.52g溶于足量盐酸中,向所得溶液中通入标准状况下112mL Cl2,恰好将Fe2+完全氧化.下列说法正确的是( )| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
分析 A.FexO中含有Fe2+;
B.根据n=$\frac{V}{{V}_{m}}$计算;
C.根据电子守恒可知,FexO被氧化为Fe3+转移的电子数和Cl2转移的电子数相等;
D.氧化物在离子方程式中要写化学式.
解答 解:A.某铁的氧化物(FexO)1.52g溶于足量盐酸中,再通入氯气,将Fe2+完全氧化,则生成Fe3+,所以FexO溶于HCl生成FeCl2,故A错误;
B.标准状况下,n=$\frac{V}{{V}_{m}}$=$\frac{0.112L}{22.4L/mol}$=0.005mol,故B错误;
C.FexO中Fe的平均化合价为+$\frac{2}{x}$,被氧化为Fe3+,根据电子守恒可知,转移的电子数和Cl2转移的电子数相等.标准状况下112mL Cl2转移电子数为$\frac{0.112L}{22.4L/mol}$×2=0.01mol.则有:$\frac{1.52g}{(56x+16)g/mol}$×(3-$\frac{2}{x}$)×x=0.01mol,解得x=0.8,故C正确;
D.氧化物在离子方程式中要写化学式,所以FexO在离子方程式中不能写成Fe2+,故D错误.
故选:C.
点评 本题考查氧化还原反应计算、离子方程式的书写,题目难度不大,注意氧化还原反应计算中电子转移守恒运用,本题中注意平均化合价的应用,侧重考查学生的分析计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 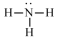 氨分子的结构式 | B. | 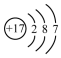 Cl-结构示意图 | C. | 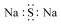 Na2S的电子式 | D. | 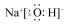 NaOH的电子式 |
9.下列叙述正确的是( )
| A. | 将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,c(SO42-)>c(NH4+) | |
| B. | NaHCO3溶液中:c (CO32-)+c(H+)=c(H2CO3)+c(OH-) | |
| C. | 1 L 0.l mol•L-1CuSO4•(NH4)2SO4•6H2O溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-) | |
| D. | 向0.1mol/L的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3•H2O)增大 |
16.下列气体中是非电解质,且和SO2一起通入到BaCl2溶液中可生成BaSO3沉淀的是( )
| A. | Cl2 | B. | H2S | C. | NH3 | D. | HCl |
6.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 17g氨气所含电子数目为8NA | |
| C. | 将1体积c1mol/L的硫酸溶于4体积水中,稀溶液的浓度为0.2c1mol/L | |
| D. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 |
13.实验需要配制KMnO4溶液,下列操作会引起所配溶液浓度偏大的是( )
| A. | 容量瓶用蒸馏水洗涤后未干燥即用来配制溶液 | |
| B. | 定容时,观察液面俯视刻度线 | |
| C. | 摇匀后,液面低于刻度线,没有再加蒸馏水 | |
| D. | 用蒸馏水洗涤烧杯和玻璃棒.并将洗涤液转移入容量瓶中 |
10.在密闭容器中发生反应:aX(g)+bY(g)?cZ(g)+dW(g)反应达到平衡后,保持温度不变,将气体压缩到原来的$\frac{1}{2}$体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述中不正确的是( )
| A. | 平衡向逆反应方向移动 | B. | a+b>c+d | ||
| C. | Z的体积分数减小 | D. | X的转化率下降 |
11.下列物质中既能导电,又属于强电解质的一组物质是( )
| A. | 石墨、醋酸溶液、食盐晶体 | B. | 熔融状态的KOH、熔融状态的NaCl | ||
| C. | 稀H2SO4、NaOH溶液、纯HNO3 | D. | 液氨、石灰水、水银 |