题目内容
11.O2和O3是氧元素的两种单质,根据其分子式完成下列各题:(1)等质量的O2和O3所含分子个数比为3:2,原子个数比为1:1.
(2)等温等压下,等体积的O2和O3所含分子个数比为1:1,原子个数比为2:3,质量比为2:3.
(3)配制100mL 1mol•L-1的稀H2SO4溶液,需要用量筒量取浓H2SO4(密度为1.84g•mL-1,质量分数为98%)的体积为5.4mL.
(4)现要配制1mol•L-1 Na2CO3溶液250mL,求:①需要含结晶水的碳酸钠晶体(Na2CO3•10H2O)71.5 g;②需要物质的量浓度为4mol•L-1的Na2CO3溶液62.5 mL.
分析 (1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,结合氧气和臭氧分子构成解答;
(2)依据阿伏伽德罗定律可知,等温等压下,等体积的气体具有相同的分子数、物质的量,结合n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$计算解答;
(3)依据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,依据溶液稀释过程中溶质的物质的量不变计算需要浓硫酸的体积;
(4)若用固体配制溶液,依据n=CV、m=nM计算需要溶质的物质的量和质量,若用浓溶液配制稀溶液,依据溶液稀释过程中溶质的物质的量不变,计算需要浓溶液的体积.
解答 解:(1)依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$,分子数之比等于分子的物质量之比,等质量的O2和O3所含分子个数比等于物质的量之比为:$\frac{m}{32}$:$\frac{m}{48}$=3:2;氧气为双原子分子,臭氧为三原子分子,所以等质量的O2和O3所含原子个数之比为:3×2:2×3=1:1;
故答案为:3:2;1:1;
(2)依据阿伏伽德罗定律可知,等温等压下,等体积的气体具有相同的分子数,所以等温等压下,等体积的O2和O3所含分子个数比为1:1,物质的量之比为1:1,原子个数比为:1×2:3×1=2:3;氧气与臭氧都是由氧原子构成,所以等物质的量的氧气与臭氧质量之比等于原子个数之比等于2:3;
故答案为:1:1; 2:3; 2:3;
(3)浓硫酸的物质的量浓度C=$\frac{1000×1.84×98%}{98}$-18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释过程中溶质的物质的量不变得:18.4mol/L×V=100mL×1mol•L-1,解答V=5.4mL;
故答案为:5.4;
(4)用Na2CO3固体配制1mol/L的Na2CO3溶液250mL,则需要固体碳酸钠的物质的量n=1mol/L×0.25L=0.25mol;
若用含结晶水的碳酸钠晶体(Na2CO3•10H2O)配制,则需要碳酸钠晶体质量m′=286g/mol×0.25mol/L=71.5g;
若用物质的量浓度为4mol/L的Na2CO3溶液配制,设需要4mol/L的Na2CO3溶液体积为V,依据溶液稀释过程中溶质的物质的量不变得:4mol/L×V=0.25mol,解得V=0.0625L,即62.5mL,
故答案为:71.5; 62.5.
点评 本题考查了物质的量有关计算,明确以物质的量为核心计算公式,熟悉溶液稀释规律是解题关键,题目难度不大.

| A. | 将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 | |
| B. | 分液操作时,静置分层后要先放出分液漏斗中下层液体,再倒出上层液体 | |
| C. | 分液操作时,选择的萃取剂的密度必须比水大 | |
| D. | 用胶头滴管向试管滴加液体时,滴管尖端靠在试管内壁 |
| A. | 铜来源广泛,易于从自然界冶炼得到 | |
| B. | 铜的化学性质比较稳定,不易被腐蚀,铜的熔点比较低,容易冶炼铸造成型 | |
| C. | 铜的外观为紫红色,大方美观,易于被人们接受 | |
| D. | 铜的化学性质不稳定,在空气中易转化为铜绿,铜绿具有抗腐蚀能力,易于流通 |
| A. | ①②④⑥ | B. | ②④⑤ | C. | ①②③④ | D. | ④⑤⑥ |
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 12.60 | 18.90 | 28.98 |
| 二氧化硫的体积/L | 1.12 | 1.68 | 2.24 |
| 硫的质量/g | 1.28 | 1.92 | 2.56 |
(2)根据上表数据分析,该样品A(填选项字母)
A.含有Na2S2O3、Na2SO3和Na2SO4三种成分
B.含有Na2S2O3和Na2SO3两种成分
C.只含有Na2S2O3
(3)求第三份样品中各成分的物质的量.
(4)求所加硫酸的物质的量浓度.
(5)若将63g该样品与一定量的该硫酸溶液微热,回答问题:
①欲计算生成SO2的体积,还需要提供的一个数据是(用a表示该数值,并注明单位)硫酸溶液的体积.当a=0.06时,V(SO2)=5.6;
②(2分)在图1上画出b随a变化的曲线
(6)图2是实验室制取SO2并验证SO2的某些性质的装置图.
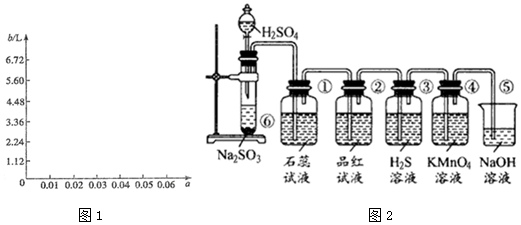
试回答:
Ⅰ.实验中应该选择浓硫酸,是否使用98%的浓H2SO4否(填“是”或“否”),写出⑥中反应化学反应方程式为Na2SO3+H2SO4=Na2SO4+H2O+SO2↑.
Ⅱ.①中的实验现象为变红.
Ⅲ.②中的现象证明SO2具有的化学性质为漂白性.
Ⅳ.③中的实验现象是变浑浊(生成淡黄色沉淀),证明SO2有氧化性.
Ⅴ.④中的实验现象是紫红色褪去,证明SO2有还原性.
Ⅵ.⑤的作用是吸收多余的SO2,防止污染空气.
| A. | FexO溶于足量盐酸后只生成了FeCl3和H2O | |
| B. | 标准状况下112 mL Cl2的物质的量是5 mol | |
| C. | x=0.8 | |
| D. | 通入Cl2后,发生反应的离子方程式:Fe2++Cl2=Fe3++2Cl- |
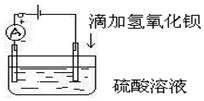 如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系.
如图所示是某化学兴趣小组探究溶液中离子浓度与溶液导电性的关系. ,COS属于极性分子(填“极性”或“非极性”).
,COS属于极性分子(填“极性”或“非极性”).