题目内容
14.根据信息,写出下列热化学方程式(1)CuCl(s)与 O2 反应生成 CuCl2 (s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是4CuCl(s)+O2(g)═2CuCl2(s)+2CuO(s)△H=-177.6kJ•mol-1.
(2)已知PCl3的熔点和沸点分别为-93.6℃和76℃,PCl5的熔点为167℃.室温时PCl3与气体Cl2反应生成1mol PCl5,放出热量123.8kJ.该反应的热化学方程式为PCl3(l)+Cl2(g)═PCl5(s)△H=-123.8kJ•mol-1.
(3)已知:H2 (g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1写出焦炭与水蒸气反应的热化学方程式:C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol-1.
分析 (1)每消耗1mol CuCl(s),放热44.4kJ,则4molCuCl反应放出热量为44.4kJ×4=177.6kJ,结合物质的状态、焓变为负书写热化学方程式;
(2)室温时PCl3与气体Cl2反应生成1mol PCl5,放出热量123.8kJ,结合物质的状态、焓变为负书写热化学方程式;
(3)①H2 (g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
由盖斯定律可知,②-①得到C(s)+H2O (g)═CO (g)+H2 (g),以此来解答.
解答 解:(1)每消耗1mol CuCl(s),放热44.4kJ,则4molCuCl反应放出热量为44.4kJ×4=177.6kJ,则热化学方程式为4CuCl (s)+O2 (g)═2CuCl2 (s)+2CuO (s)△H=-177.6 kJ•mol-1,
故答案为:4CuCl (s)+O2 (g)═2CuCl2 (s)+2CuO (s)△H=-177.6 kJ•mol-1;
(2)室温时PCl3与气体Cl2反应生成1mol PCl5,放出热量123.8kJ,则热化学方程式为PCl3(l)+Cl2 (g)═PCl5 (s)△H=-123.8 kJ•mol-1,
故答案为:PCl3(l)+Cl2 (g)═PCl5 (s)△H=-123.8 kJ•mol-1;
(3)①H2 (g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-241.8kJ•mol-1
②C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5kJ•mol-1,
由盖斯定律可知,②-①得到C(s)+H2O (g)═CO (g)+H2 (g),△H=(-241.8kJ•mol-1)-(-110.5kJ•mol-1)=+131.3 kJ•mol-1,
则焦炭与水蒸气反应的热化学方程式为C(s)+H2O (g)═CO (g)+H2 (g)△H=+131.3 kJ•mol-1,
故答案为:C(s)+H2O (g)═CO (g)+H2 (g)△H=+131.3 kJ•mol-1.
点评 本题考查热化学方程式,为高频考点,把握反应中能量变化、热化学方程式的书写方法为解答关键,侧重分析与应用能力的考查,注意盖斯定律的应用,题目难度不大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=-574kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=-1160kJ/mol
下列说法正确的是( )
| A. | 等物质的量的CH4在反应①、②中转移的电子数不相同 | |
| B. | CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l);△H>-574kJ/mol | |
| C. | 4NO2(g)+2N2(g)═8NO(g);△H=+586kJ/mol | |
| D. | 若用2.24LCH4把NO2还原为N2,整个过程中转移的电子总数为0.8NA |
| 操作过程 | 实验现象描述 | 对应离子方程式或化学方程式 |
| FeCl2中通入Cl2 | 溶液变黄 | 2Fe2++Cl2=2Fe3+ |
| Fe(OH)2放置空气 | 白色沉淀迅速变为灰绿色,最终变为红褐色 | 4Fe(OH)2+O2+4H2O=4Fe(OH)3 |
| KI溶液中通入氯气,加入CCl4后震荡 | 溶液变为棕色,加入四氯化碳后分层,且四氯化碳层显紫色 | Cl2+2I-=2Cl-+I2 |
| 盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量 | 先无沉淀,后生成白色沉淀 | [Al(OH)4]-+4H+=Al3++4H2O,3[Al(OH)4]-+Al3+=4Al(OH)3↓ |
| A. | 13.8g | B. | 8.5g | C. | 9.8g | D. | 8.89 |
| A. | BeCl2、CO2 | B. | H2O、SO2 | C. | SO2、CH4 | D. | NF3、CH2O |
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,△S=+133.7J•(K•mol) -1该反应能否自发进行与温度 有关.
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)?CO2(g)+H2(g),得到如表三组数
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
②该反应为吸热(填“吸”或“放”)热反应
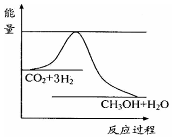
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ•mol-1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,下列措施中能使c (CH3OH)增大的是cd.
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3mol H2.