题目内容
9.7.2g镁条在只含有CO2和N2混合气体的容器中燃烧,反应后容器内固体物质的质量不可能为( )| A. | 13.8g | B. | 8.5g | C. | 9.8g | D. | 8.89 |
分析 极限思想,假设混合气体都是CO2,则2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C,根据镁的质量求生成固体的质量,假设混合气体都是N2,则3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$ Mg3N2,并根据镁的质量求生成固体的质量,最终固体应该在这两者之间,据此分析.
解答 解:假设混合气体都是CO2,则2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C,
48 40 12
7.2 m(MgO)m(C)
$\frac{48}{7.2}=\frac{40}{m(MgO)}=\frac{12}{m(C)}$,解得 m(MgO)=6g,m(C)=1.8g,则固体的质量为6g+1.8g=7.8g
假设混合气体都是N2,则3Mg+N2$\frac{\underline{\;点燃\;}}{\;}$ Mg3N2,
72 100
7.2 10,则固体的质量为10g
则最终固体应该在这两者之间7.8<m<10,
故选A.
点评 本题考查了有关混合物的计算,题目难度中等,明确镁与氮气、二氧化碳的反应原理为解答本题的关键,注意极限法在化学计算中的应用.

| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
| A. | CH4 | B. | C2H2 | C. | C3H8 | D. | C2H6 |
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
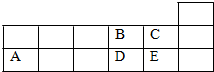
| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
| A. | Fe3+、H+、SO42-、ClO- | B. | Fe3+、Fe2+、SO42-、NO3- | ||
| C. | Al3+、Na+、SO42-、CO32- | D. | K+、H+、Br-、MnO4- |
| A. | 配制0.1 mol•L-1 NaCl溶液时,其中一步是将已准确称量的NaCl放入烧杯中并加适量的水搅拌溶解 | |
| B. | 配制1 mol•L-1 NaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶 | |
| C. | 配制0.1 mol•L-1的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释 | |
| D. | 配制1 mol•L-1 Na2CO3溶液500 mL,将Na2CO3放在托盘天平右盘称量 |
