题目内容
4.一种测定饮料中糖类物质含量(所有糖类物质以葡萄糖计算)的方法如下:取某无色饮料20.00mL加入稀硫酸充分煮沸,冷却,加入过量氢氧化钠溶液并稀释至 100.00mL.取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液25.00mL.
己知:
①I2在碱性条件下能与葡萄糖发生如下反应:C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O
②Na2S2O3 与I2能发生如下反应:I2+2Na2S2O3=2NaI+Na2S4O6
(1)配制100.00mL0.01500mol•L-1I2标准溶液,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和l00mL容量瓶.
(2)向饮料中加入稀硫酸并充分煮沸的目的是将饮料中糖类物质转化为葡萄糖.
(3)滴定终点的现象为溶液由蓝色恰好变为无色,且半分钟内不变色.
(4)计算该饮料中糖类物质的含量(单位:mg•mL-1).
分析 (1)配制100.00mL0.01500mol•L-1I2标准溶液,先在烧杯中溶解药品,用玻璃棒搅拌,转移到100mL容量瓶,定容,据此选择所必需的玻璃仪器;
(2)向饮料中加入稀硫酸并充分煮沸使糖类水解为葡萄糖;
(3)取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,溶液颜色蓝色褪去证明反应恰好完成;
(4)C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O,Na2S2O3 与I2能发生如下反应:I2+2Na2S2O3=2NaI+Na2S4O6,结合C6H12O6~I2~2Na2S2O3,先计算和葡萄糖反应的碘单质,结合化学方程式C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O,计算葡萄糖含量.
解答 解:(1)配制100.00mL0.01500mol•L-1I2标准溶液,先在烧杯中溶解药品,用玻璃棒搅拌,转移到100mL容量瓶,定容,所必需的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL容量瓶,故答案为:l00mL容量瓶;
(2)向饮料中加入稀硫酸并充分煮沸的目的是:将饮料中糖类物质转化为葡萄糖,
故答案为:将饮料中糖类物质转化为葡萄糖;
(3)取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,置于暗处15分钟,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,溶液颜色蓝色褪去证明反应恰好完成,滴定终点的现象为:溶液由蓝色恰好变为无色,且半分钟内不变色,
故答案为:溶液由蓝色恰好变为无色,且半分钟内不变色;
(4)取某无色饮料20.00mL加入稀硫酸充分煮沸,冷却,加入过量氢氧化钠溶液中和稀硫酸并稀释至 100.00mL,取 10.00mL 稀释液,加入 30.00mL 0.01500mol•L-1I2标准溶液,物质的量n(I2)=0.030.00L×0.01500mol•L-1=4.5×10-4mol,滴加2〜3滴淀粉溶液,再用0.01200mol•L-1Na2S2O3标准溶液滴定至终点,共消耗Na2S2O3标准溶液25.00mL,
I2~2Na2S2O3,
1 2
1.5×10-4mol 0.01200mol•L-1×0.025.00L=3×10-4mol
与葡萄糖反应的碘单质物质的量n=4.5×10-4mol-1.5×10-4mol=3×10-4mol,
C6H12O6+I2+3NaOH═C6H11O7Na+2NaI+2H2O
得到葡萄糖物质的量=3×10-4mol,
该饮料中糖类物质的量=3×10-4mol×$\frac{100}{10}$=3×10-3mol,
计算该饮料中糖类物质的含量=$\frac{3×1{0}^{-3}mol×180g/mol}{20ml}$=0.02700g/ml=27.0mg•mL-1 ,
故答案为:27.00mg•mL-1.
点评 本题考查了物质组成的实验测定、物质性质、滴定实验过程分析和计算,掌握基础是解题关键,题目难度中等.

| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 300 | 230 | 169 | 58 |
| 30 | 158 | 108 | 50 | 15 |
| 50 | 31 | 26 | 15 | 7 |
(2)在30℃、pH=5.0条件下,O3的分解速率为2.00×10-4 mol•L-1•min-1,O2的浓度为0.015mol/L.
(3)据表中的递变规律,推测O3在下列条件下分解速率的关系:Ⅰ<(填“>”“<”或“=”)Ⅱ.
Ⅰ.40℃,pH=3.0
Ⅱ.30℃,pH=7.0.
| A. | 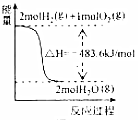 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 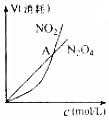 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 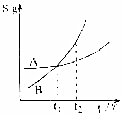 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 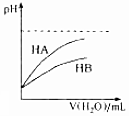 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
| A. | 常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0 | |
| B. | 正四面体分子晶体内的键角一定是109°28′ | |
| C. | CuSO4溶液能使蛋白质溶液产生沉淀,该过程可用于提纯蛋白质 | |
| D. | NH3•H2O溶液加水稀释后,溶液中$\frac{c(N{H}_{3}{H}_{2}O)}{c(N{H}_{{4}^{+}})}$的值增大 |
| A. | pH均为2的醋酸和盐酸加水稀释100倍,所得溶液的pH:醋酸>盐酸 | |
| B. | pH为11的氨水和pH为3的盐酸溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol/L的NaOH溶液和CH3COONa溶液等体积混合后的溶液:c(Na+)+c(CH3COO-)=c(OH-)+c(H+) | |
| D. | 浓度均为0.1mol/L的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |
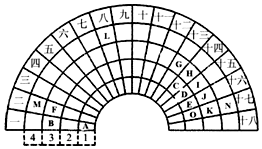 元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题:
元素周期表的形式多种多样,如图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表,思考扇形元素周期表的填充规律,并回答下列问题: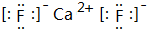 ,用电子式表示CJ2的形成过程:
,用电子式表示CJ2的形成过程: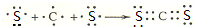 .
.