题目内容
2.根据实验操作过程,将表格补充完整| 操作过程 | 实验现象描述 | 对应离子方程式或化学方程式 |
| FeCl2中通入Cl2 | 溶液变黄 | 2Fe2++Cl2=2Fe3+ |
| Fe(OH)2放置空气 | 白色沉淀迅速变为灰绿色,最终变为红褐色 | 4Fe(OH)2+O2+4H2O=4Fe(OH)3 |
| KI溶液中通入氯气,加入CCl4后震荡 | 溶液变为棕色,加入四氯化碳后分层,且四氯化碳层显紫色 | Cl2+2I-=2Cl-+I2 |
| 盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量 | 先无沉淀,后生成白色沉淀 | [Al(OH)4]-+4H+=Al3++4H2O,3[Al(OH)4]-+Al3+=4Al(OH)3↓ |
分析 FeCl2中通入Cl2发生氧化还原反应生成FeCl3;Fe(OH)2放置空气被氧化生成Fe(OH)3;KI溶液中通入氯气,被氧化生成碘,碘易溶于四氯化碳;盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量,先无沉淀,后生成氢氧化铝白色沉淀,以此解答该题.
解答 解:FeCl2中通入Cl2发生氧化还原反应生成FeCl3,可观察到溶液变黄色,反应的离子方程式为2Fe2++Cl2=2Fe3+;
Fe(OH)2放置空气被氧化生成Fe(OH)3,可观察到白色沉淀迅速变为灰绿色,最终变为红褐色,反应的化学方程式为4Fe(OH)2+O2+4H2O=4Fe(OH)3,
KI溶液中通入氯气,被氧化生成碘,碘易溶于四氯化碳,可观察到溶液变为棕色,加入四氯化碳后分层,且四氯化碳层显紫色,反应的离子方程式为Cl2+2I-=2Cl-+I2;
盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量,先无沉淀,后生成氢氧化铝白色沉淀,反应的离子方程式为[Al(OH)4]-+4H+=Al3++4H2O,3[Al(OH)4]-+Al3+=4Al(OH)3↓,
故答案为:
| 操作过程 | 实验现象描述 | 对应离子方程式或化学方程式 |
| FeCl2中通入Cl2 | 溶液变黄 | 2Fe2++Cl2=2Fe3+ |
| Fe(OH)2放置空气 | 白色沉淀迅速变为灰绿色,最终变为红褐色 | 4Fe(OH)2+O2+4H2O=4Fe(OH)3 |
| KI溶液中通入氯气,加入CCl4后震荡 | 溶液变为棕色,加入四氯化碳后分层,且四氯化碳层显紫色 | Cl2+2I-=2Cl-+I2 |
| 盐酸溶液中缓慢滴加Na[Al(OH)4]溶液至过量 | 先无沉淀,后生成白色沉淀 | [Al(OH)4]-+4H+=Al3++4H2O,3[Al(OH)4]-+Al3+=4Al(OH)3↓ |
点评 本题综合考查元素化合物知识,为高频考点,侧重考查学生的双基以及元素化合物知识的综合理解和运用,注意把握物质的性质以及反应现象的判断,难度不大.

练习册系列答案
相关题目
12.关于下列各图的叙述,正确的是( )
| A. | 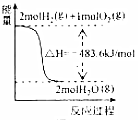 表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ•mol-1 | |
| B. | 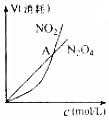 表示恒温恒容条件下发生的可逆反应2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| C. | 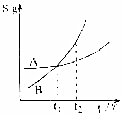 表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数A=B | |
| D. | 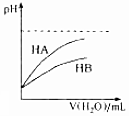 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH大于NaB溶液 |
13.下列关于铯(Cs)及其化合物的性质的说法中,正确的是( )
| A. | 金属铯的密度比金属钠小 | B. | 金属铯的熔点比金属钠高 | ||
| C. | Cs与H2O能剧烈反应,甚至发生爆炸 | D. | 碳酸铯难溶于水 |
10.常温下.弱碱MOH的电离常数K=1.0×10-3,0.1mol•L-1 MOH溶液的pH约为( )
| A. | 8 | B. | 9 | C. | 11 | D. | 12 |
17.高铁酸钾K2FeO4是一种高效、氧化性比Cl2更强的水处理剂,工业上常用下列反应先制高铁酸钠:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,然后在低温下,在Na2FeO4溶液中加KOH固体至饱和就可析出K2FeO4,下列有关说法不正确的是( )
| A. | Na2O2在反应中作氧化剂,又作还原剂 | |
| B. | 高铁酸钾在该温度下的溶解度比高铁酸钠的溶解度小 | |
| C. | K2FeO4能消毒杀菌,其还原产物水解生成的Fe(OH)3胶体能吸附水中的悬浮物 | |
| D. | 制取高铁酸钠时,每生成1mol Na2FeO4反应中共有4mol电子转移 |
11.某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4•(NH4)2 SO4•6H2O]处理,反应中铁元素和铬元素完全转化为沉淀.该沉淀干燥后得到n molFeO•FeyCrxO3.不考虑处理过程中的实际损耗,下列叙述正确的是( )
| A. | 消耗硫酸亚铁铵的物质的量为n(2-x)mol | |
| B. | 处理废水中Cr2O72- 的物质的量为nxmol | |
| C. | 反应中发生转移的电子数为3n mol | |
| D. | 在FeO•FeyCrxO3中3x=y |
 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).